中药注射剂原料中药材实施GAP现状及展望
时间:2023-09-04人气:作者: 百草药源
来源:《中国中药杂志》2021,46(20)
基于GAP认证对我国中药生产基地建设的分析
张文晋 曹也 张燕 葛阳 王升 康传志 万修福 许海玉 郭兰萍
中国中医科学院中药资源中心道地药材国家重点实验室培育基地 安徽中医药大学药学院 中国中医科学院中药研究所 国家药品监督管理局中药监管科学研究中心
中药注射剂是指药材经提取、纯化后制成的供注入体内的溶液、乳状液及供临用前配制成溶液的粉末或浓溶液的无菌制剂。中药注射剂突破了中药传统的给药方式,具有生物利用度高、疗效确切、作用迅速的特点,其在临床上应用较为广泛。然而,随着中药注射剂在临床上的广泛应用,关于中药注射剂质量安全问题的报道逐渐增多。注射剂是对品质要求最高的剂型之一,其对于产品质量的一致性与可控性有着比其他中药产品更高的要求。提高中药注射剂质量,保障临床用药安全,已成为中药注射剂研究领域的热点。中药注射剂绝大多数是提取混合物,未分离出能够完全定性和定量的有效成分,影响其质量安全的因素主要包括原料质量不稳定、质量标准不完善、配伍不当等。中药注射剂的原料中药材主要来源为对外采购和生产企业自有基地生产,但受产地、气候、采收等的影响,不同批次的药材的有效成分存在较大差异,如何保障中药材质量稳定是企业亟待解决的问题。
我国自1998年以来起草并实施中药材生产质量管理规范(GAP),一些中药注射剂生产企业按照GAP要求进行种植管理,截至2016年2月,已有129家企业167种中药材通过国家药监局的GAP认证。2016年2月15日,国家食品药品监督管理总局官网消息显示,国务院印发《关于取消13项国务院部门行政许可事项的决定》(国发[2016]10号),规定取消中药材生产质量管理规范(GAP)认证。2017年9月国务院关于开展质量提升行动的指导意见中明确要求要提高中药质量稳定性和可控性。在党中央、国务院大力扶持和促进中医药事业发展,中药注射剂又频发不良反应面临质量危机的大背景下,为了从源头控制好中药材的质量,更需要中药材GAP认证制度迅速完善、大力推广、逐步实施。
本研究在Google Scholar、PubMed、中国知网、万方等数据库中,通过关键词检索并筛选1998年至今已发表的中英文相关文献100余篇,开展文献分析研究;在此基础上,分析全国中药注射剂重点品种GAP管理现状及原料药材实施GAP管理对中药注射剂质量一致性和可控性的影响,论证在中药注射剂安全性再评价基础上全面实施GAP的合理性、必要性及可行性。
1 中药注射剂产业现状分析
1.1 中药注射剂产品概况
通过国家药品监督管理局网站(http: //app1.nmpa.gov.cn/data_nmpa/face3/dir.html)、国家药品监督管理局南方医药经济研究所米内网数据库(http: //shuju.menet.com.cn/NEWVIPZone/KKSearch/kkSearchIndex.jsp)统计中药注射剂相关信息。截至2020年8月20日,国家药品监督管理局药品查询网站上共有131种中药注射剂,其中61种是独家生产的。76种(58%)由单一中药制成,55种(42%)由2种或2种以上中药制成。最复杂的配方是清热解毒注射液由12种中药组成,复方蛤青注射液含有9种中药,见图1。
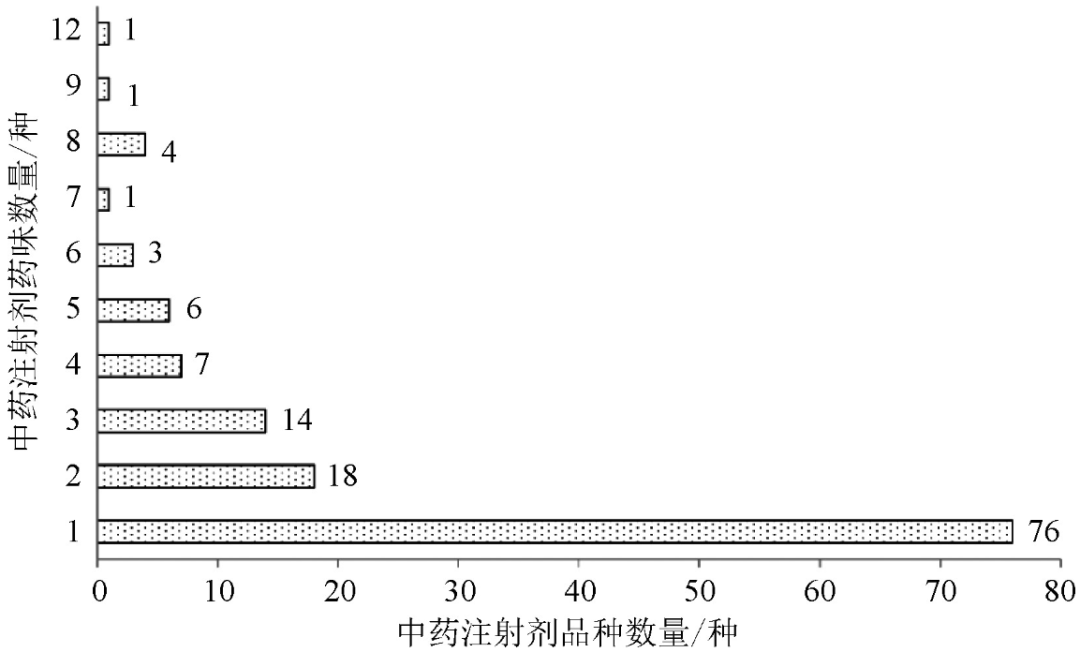
图1 中国已上市中药注射剂品种分布情况(药味组成)
95种(72.5%)中药注射剂仅推荐用于一种特定的给药途径,其中55种只进行肌肉注射,35种只进行静脉滴注,3种只注射到痔疮组织中,1种注射到患病的前列腺中,1种注射到相关的穴位中。其余36种(27.5%)中药注射剂有多种给药途径:17种中药注射剂可肌内注射或静脉滴注;4种静脉滴注或静脉推注,2种肌内注射或穴位注射,肌内注射或静脉推注、肌内注射或皮下注射、肌内注射或痛点注射各1种;10种中药注射剂有3种或更多给药途径。含有静脉推注11个品种[双黄连注射液、参附注射液、血栓通注射液、注射用血栓通(冻干)、注射用血塞通(冻干)、丹参注射液、丹红注射液、丹香冠心注射液、瓜蒌皮注射液、香菇多糖注射液、康艾注射液],不同的给药途径和相应的中药注射剂数量,见图2。
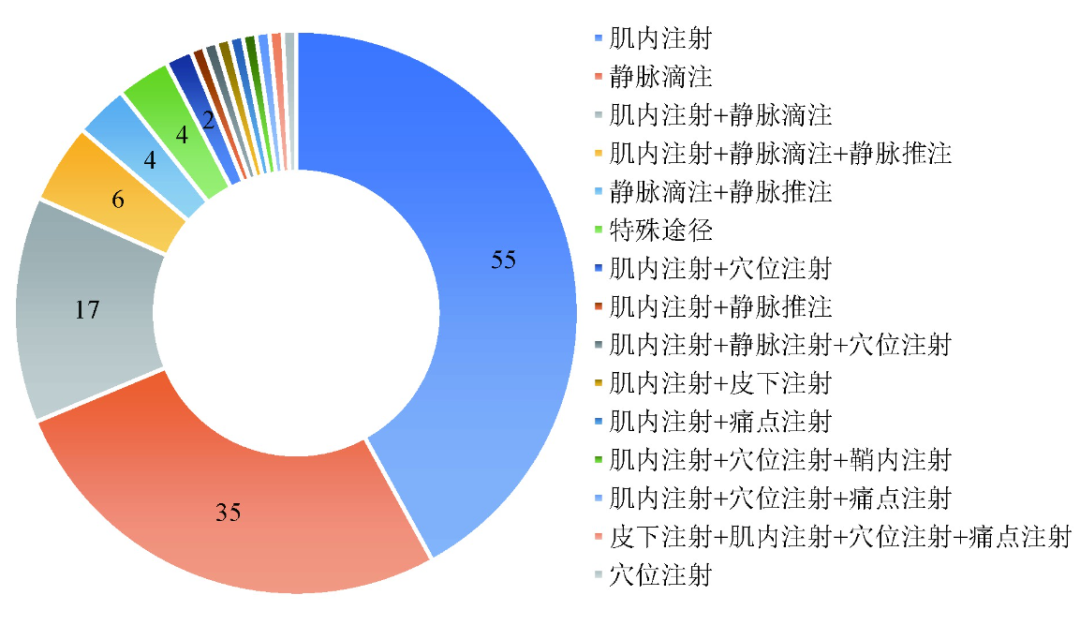
图2 不同的给药途径和相应的中药注射剂数量
1.2 中药注射剂市场概况
2017年中药注射剂的市场规模已突破1 000亿,见图3,约占2017年中国中药行业市场总规模的13%,占中成药市场规模的1/3左右。自2008年以来,多数中药注射剂产品销售毛利率在70%以上,尤其是销量较高的独家品种。2019年中国公立医疗机构终端中成药销售额前20的中成药中,中药注射剂占据11席(数据来源于米内网终端格局数据库,见表1)。但近年来受医保限制、重点监控、修订说明书等政策影响,从2017年开始,中药注射剂市场增速出现了下滑趋势,中药注射剂已呈现负增长。从政策层面来看,国家对中成药特别是中药注射剂的监管日趋严格。2019版国家医保药品目录用药限制的中药注射剂品种由2018年的26个扩大到了45个,涉及血塞通注射液、血栓通注射液、黄芪注射液、舒血宁注射液、益母草注射液等,这些品种包括年销售几十亿元的大品种。在2019年医保目录中,常规目录中有36种中药注射剂仅限二级及以上医疗机构,而且使用范围偏向重症,进一步限制了中药注射剂的销量。
1.3 中药注射剂的不良反应
注射剂被直接注入血管、人体组织或器官,不经胃肠道代谢与屏障,避免了首过效应,生物利用度大幅提升;但如果有害物质伴随着药物成分同时进入人体,常常会发生不良反应。《国家药品不良反应监测年度报告(2020年)》显示,中药不良反应/事件报告占总报告数的13.4%,其中注射给药占33.3%;化学药不良反应/事件报告占总报告数的83.0%,其中注射剂占60.4%。中药注射剂的不良反应报告数及发生率均低于西药注射剂,见表2。清开灵注射液、参麦注射液、双黄连注射液、血塞通注射液、丹参注射液、香丹注射液和舒血宁注射液是不良反应报告中发生率较高的中药注射剂品种,见表3。
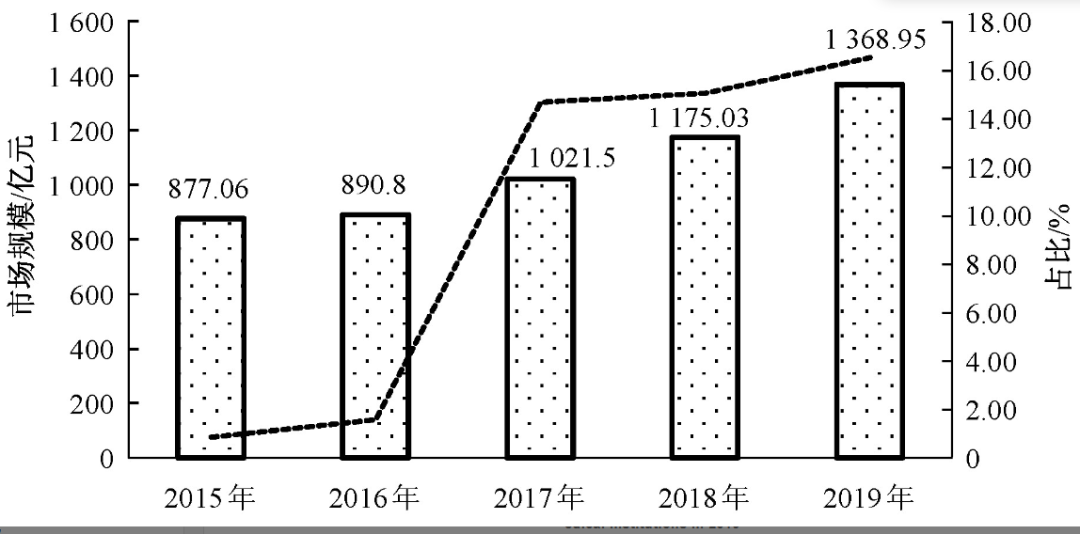
图3 2015—2019年中药注射剂市场规模
表1 2019年中国公立医疗机构终端中成药品牌top 20
| 排名 | 药品名称 | 企业名称 | 销售额/亿元 | 增长率/% | 药品亚类 |
| 1 | 注射用血栓通(冻干) | 广西梧州制药(集团)股份有限公司 | 62.83 | -1.16 | 脑血管疾病用药 |
2 | 注射用丹参多酚酸盐 | 上海绿谷制药有限公司 | 41.35 | -2.83 | 心血管疾病用药 |
3 | 丹红注射液 | 山东丹红制药有限公司 | 36.15 | -23.50 | 脑血管疾病用药 |
4 | 百令胶囊 | 杭州中美华东制药有限公司 | 34.86 | 18.09 | 壮腰健肾药 |
5 | 喜炎平注射液 | 江西青峰药业有限公司 | 31.22 | 5.30 | 清热解毒用药 |
6 | 丹参川芎嗪注射液 | 贵州拜特制药有限公司 | 29.7 | -14.40 | 脑血管疾病用药 |
7 | 蓝芩口服液 | 扬子江药业集团有限公司 | 27.87 | 33.01 | 咽喉用药 |
8 | 脑心通胶囊 | 陕西步长制药有限公司 | 26.31 | -2.61 | 脑血管疾病用药 |
9 | 康艾注射液 | 长白山制药股份有限公司 | 26.01 | -17.10 | 肿瘤疾病用药 |
10 | 复方丹参滴丸 | 天力医药集团有限公司 | 25.87 | -2.48 | 心血管疾病用药 |
11 | 康莱特注射液 | 浙江康莱特药业有限公司 | 23.55 | -8.13 | 肿瘤疾病用药 |
12 | 蒲地蓝消炎口服液 | 济川药业集团 | 22.89 | -15.96 | 清热解毒用药 |
13 | 醒脑静注射液 | 无锡济民可信山禾药业股份有限公司 | 22.24 | -12.47 | 脑血管疾病用药 |
14 | 丹参酮ⅡA磺酸钠注射液 | 上药第一生化药业有限公司 | 20.91 | -1.34 | 心血管疾病用药 |
15 | 通心络胶囊 | 石家庄以岭药业股份有限公司 | 20.32 | 3.35 | 心血管疾病用药 |
16 | 疏血通注射液 | 牡丹江友搏药业股份有限公司 | 19.87 | -38.61 | 脑血管疾病用药 |
17 | 注射用血塞通(冻干) | 珍宝岛药业股份有限公司 | 19.68 | -18.49 | 脑血管疾病用药 |
18 | 稳心颗粒 | 山东步长制药股份有限公司 | 19.67 | -2.35 | 心血管疾病用药 |
19 | 注射用血塞通(冻干) | 昆药集团股份有限公司 | 19.59 | 3.03 | 脑血管疾病用药 |
20 | 苏黄止咳胶囊 | 扬子江药业集团北京海燕药业有限公司 | 19.14 | 21.04 | 止咳祛痰平喘用药 |
然而中药注射剂安全性问题也不能小视:中药涉及的不良反应/事件报告占比远少于化学药,但中药的临床使用频次也远低于化学药;其次中药安全风险可控性远不及化学药,如大多数中药注射剂产品说明书极为简单,其“不良反应”项是“尚不明确”。2018年5月29日—6月14日,国家药品监督管理局相继发布公告,决定修改柴胡注射液、丹参注射液、双黄连注射液、天麻素注射液的说明书;7月3日,国家药品监督管理局再发公告,修改清开灵注射剂和注射用益气复脉(冻干)的说明书。这些修改多数集中在安全性内容上,或增加了儿童、孕妇等特殊人群禁用或限用的内容,或增加不良反应的相关内容以及警示语。随着人们对中药安全性问题认识的不断深化、检测手段的不断发展、药品监管体系的不断完善以及社会舆论媒体对中药安全问题的广泛关注,中药安全性问题比以往任何时期更易被发现、披露和处理,这也反映出我国药品安全监管能力和水平在提升。
中药注射剂安全性问题产生的原因包括产品不合理使用和产品本身质量问题两方面。其中最主要的原因是不合理用药,首先是误用滥用,违背中医辨证论治原则必然会增加不良反应发生的风险;其次是用药方式不合理,如输液剂基质(溶媒)选择不当、配伍不合理、给药剂量过大及给药速度过快等。产品本身质量问题主要受制剂因素和原料因素影响。现有中药注射剂部分制备工艺比较落后,如制备过程中蛋白质和鞣质去除不完全,易引起不良反应;此外,研究表明中药注射剂的部分安全隐患是由辅料[聚山梨酯-80(吐温-80)、β-环糊精等]引起的。原料药材质量参差不齐、缺乏严格质量控制,其制备而成的中药注射剂,也容易出现安全隐患。中药注射剂中主要药效活性物质受到物理因素、化学因素等的影响,可能发生氧化、水解等反应导致其降解形成杂质、有关物质,或者发生发霉、变质,从而产生一系列等不良反应。
表2 不同类型的医药产品不良反应报告
年份 | 中药 | 化学药 | 生物药 | |||
注射剂(%) | 口服制剂(%) | 注射剂(%) | 口服制剂(%) | 注射剂(%) | 口服制剂(%) | |
2015 | 124 168(51.3) | 117 686(48.66) | 714 026(62.9) | 421 150(37.1) | NA | NA |
2016 | 129 777(53.7) | 93 285(38.6) | 756 377(61.9) | 347 109(32.1) | 20 592(90) | 2 288(10) |
2017 | 138 100(54.6) | 95 102(37.6) | 867 625(66.7) | 394 138(30.3) | 16 762(97) | 518(3) |
2018 | 114 945(49.3) | 101 659(43.6) | 855 992(67) | 383 280(30) | 23 117(96.5) | 120(0.5) |
2019 | 94 478(45.5) | 96 347(46.4) | 918 932(66.2) | 413 658(29.8) | 25 506(97.5) | 78(0.3) |
2020 | 80 230(33.3) | 135 885(56.4) | 901 373(60.4) | 522 319(35) | 18 670(94.4) | 59(0.3) |
注:NA.无可用信息(表3同)。
表3 中药及中药注射剂不良反应报告数(占比)及发生率前3种
| 年份 | 总报告数 /例 | 中药报告数/例 (占比/%) | 中药注射剂报告 数/例(占比/%) | 中药注射剂严重不良 反应报告数/例(占比/%) | 中药注射剂联合用药 报告数/例(占比/%) | 中药注射剂不良反应 发生率最高前3种 |
| 2010 | 692 904 | 95 621(13.8) | 48 525(7) | NA | NA | SHL、QKL、SM |
2011 | 852 799 | NA | 65 572(7.69) | 4 034(0.47) | NA | QKL、SHL、SM |
2012 | 1 200 000 | 205 200(17.1) | 103 000(8.58) | 5 500(0.46) | NA | QKL、SM、SHL |
2013 | 1 317 000 | 227 841(17.3) | 121 000(9.19) | 6 776(0.51) | 49 610(41) | QKL、SM、DS |
2014 | 1 328 000 | 229 744(17.3) | 127 000(9.56) | 8 509(0.64) | 53 721(42.3) | QKL、SM、SHL |
2015 | 1 398 000 | 241 854(17.3) | 127 000(9.08) | 9 798(0.7) | 55 118(43.4) | QKL、SM、XST |
2016 | 1 430 000 | 241 670(16.9) | 130 018(9.09) | NA | NA | NA |
2017 | 1 429 000 | 230 069(16.1) | 138 100(9.66) | 14 523(1.02) | NA | NA |
2018 | 1 597 000 | 233 162(14.6) | 114 984(7.2) | 17 088(1.07) | NA | NA |
2019 | 1 514 000 | 192 278(12.7) | 87 211(5.7) | NA | NA | NA |
2020 | 1 676 000 | 22 378(13.4) | 74 515(4.45) | 7 437(0.44) | NA | NA |
注:SHL.双黄连注射剂;QKL.清开灵注射剂;SM.参麦注射剂;XST.血塞通注射剂;DS.丹参注射剂。
2 全国中药注射剂重点品种及GAP管理现状
本文选取2019年中国公立医疗机构终端中成药销售额前20的11种中药注射剂和不良反应报告最多的7种中药注射剂共18个品种作为重点品种,统计其GAP实施情况,见表1。中药注射剂重点品种的原料中药材主要有丹参、三七、红花、穿心莲、黄芪、人参、苦参、薏苡仁、银杏等18种,见表4。根据上述中药注射剂重点品种的规格、销售额、指标性成分含量及对应原料药材化学成分含量、亩产量等计算原料药材年需求量。中药注射剂重点品种原料药材年需求量超过1万亩(1亩≈667 m2)的中药材有三七、丹参、红花、薏苡仁4种,其中红花、丹参、三七的用量最大,年需求量分别为9.18、8.4、3.67万亩,见表5。之前已通过GAP认证的红花、丹参、三七基地面积分别为0.9万~1.8万、0.9万~1.8万、1.5万~3.0万亩。红花的GAP种植总面积占其年需求量的9.8%~19.6%;三七的GAP种植总面积占其年需求量的10.7%~21.4%;丹参的GAP种植总面积占其年需求量的41%~82%。人参、苦参、黄芪、黄芩等的GAP总种植面积能满足中药注射剂重点品种原料药材的年需求量。连翘、降香等尚无GAP基地。
3 原料药材实施GAP管理有利于提升中药注射剂质量的一致性与可控性
注射剂不良反应偏高是剂型问题,相对于口服药和外用药剂型,中药注射剂在稳定性及可控性方面应有更高要求。2017年9月,《中共中央 国务院关于开展质量提升行动的指导意见》中也明确要求要提高中药质量稳定性和可控性。按照《中药、天然药物注射剂基本技术要求》,中药注射剂的质量控制仍有诸多环节需要加强。
不同于化学药品注射剂仿制药质量和疗效一致性评价,中药注射剂需要提升批次间的一致性,即同一品种的注射剂不同批次间所含成分,无论是活性成分还是非活性成分的含量及其相互比例的恒定性。不同厂家生产同一品种注射剂,质量也必须保持恒定。如果不能保持质量的稳定性和可控性,其所含成分及成分比例不一致,很可能带来临床疗效与安全性差异,引发不良事件,甚至发生不良反应。中药注射剂质量稳定性和可控性是一个系统工程,与单一成分的化学药品质量控制不同,涉及因素包括:原药材质量、制剂工艺、辅料及其质量标准等。《中药、天然药物注射剂基本技术要求》制定了比较严格的质量要求,其中与原料药材质量控制相关的要求主要包括注射剂用药材一般应固定品种、药用部位、产地、产地加工、采收期等;以炮制品入药的应明确详细的炮制方法。以药材或饮片投料的,为保证质量稳定,应制订中间体的质量标准。原料(药材、饮片、提取物、有效部位等)、中间体、制剂均应分别研究建立指纹图谱。还应进行原料、中间体、制剂指纹图谱的相关性研究等。这些规定有利于控制中药注射剂质量。但目前中药注射剂仍存在质量良莠不齐的问题。而诸多环节中以中药原药材的质量稳定性、中间体质量稳定性、已知与未知成分的复杂性3个环节最重要,直接影响注射剂的最终质量。本文重点聚焦原料药材质量控制。
表4 中药注射剂重点品种原料组成及销售量
No. | 名称 | 原料成分 | 原料药材 | 销售量/万盒 |
| 1 | 注射用血栓通(冻干) | 三七总皂苷 | 三七 | 20 943 |
2 | 注射用丹参多酚酸 | 丹参多酚酸 | 丹参 | 1 199 |
3 | 丹红注射液 | 丹参、红花 | 丹参、红花 | 4 635 |
4 | 喜炎平注射液 | 穿心莲内酯磺化物 | 穿心莲 | 2 081 |
5 | 丹参川芎嗪注射液 | 丹参、盐酸川芎嗪 | 丹参 | 888 |
6 | 康艾注射液 | 黄芪、人参、苦参素 | 黄芪、人参、苦参 | 2 890 |
7 | 康奈特注射液 | 薏苡仁油 | 薏苡仁 | 1 682 |
8 | 醒脑静注射液 | 麝香、郁金、冰片、栀子 | 麝香、郁金、冰片、栀子 | 6 354 |
9 | 丹参酮ⅡA磺酸钠注射液 | 丹参酮ⅡA磺酸钠 | 丹参 | 1 549 |
10 | 疏血通注射液 | 水蛭、地龙 | 水蛭、地龙 | 431 |
11 | 注射用血塞通(冻干) | 三七总皂苷 | 三七 | 13 120 |
12 | 清开灵注射液 | 胆酸、珍珠母(粉)、猪去氧胆酸、栀子、水牛角(粉)、板蓝根、黄芩苷、金银花 | 栀子、板蓝根、黄芩、金银花、珍珠母 | 7 000 |
13 | 参麦注射液 | 红参、麦冬 | 红参、麦冬 | 8 997 |
14 | 双黄连注射液 | 金银花、黄芩、连翘 | 金银花、黄芩、连翘 | 800 |
15 | 血塞通注射液 | 三七总皂苷 | 三七 | 18 433 |
16 | 丹参注射液 | 丹参 | 丹参 | 11 269 |
17 | 香丹注射液 | 丹参、降香 | 丹参、降香 | 1 284 |
18 | 舒血宁注射液 | 银杏叶 | 银杏 | 16 943 |
表5 全国中药注射剂重点品种年需求量前10的原料中药材GAP占比
No. | 原料 药材 | GAP种植/ 养殖总面积 /万亩 | GAP基 地个数 | 药材年 需求量 /万亩 | GAP药材 占比 /% |
| 1 | 红花 | 0.9~1.8 | 6 | 9.18 | 9.8~19.6 |
2 | 三七 | 0.9~1.8 | 6 | 8.40 | 10.7~21.4 |
3 | 丹参 | 1.5~3.0 | 10 | 3.67 | 41~82 |
4 | 薏苡仁 | 0.3~0.6 | 2 | 1.17 | 25.6~51.3 |
5 | 人参 | 1.8~3.6 | 12 | 0.430 | 100 |
6 | 苦参 | 0.15~0.3 | 1 | 0.079 0 | 100 |
7 | 黄芪 | 0.9~1.8 | 6 | 0.077 0 | 100 |
8 | 黄芩 | 0.45~0.9 | 3 | 0.028 0 | 100 |
9 | 银杏 | 0.45~0.9 | 3 | 0.007 0 | 100 |
10 | 麦冬 | 1.2~2.4 | 8 | 0.001 0 | 100 |
中药材是中药注射剂的直接原料,也是中药注射剂质量控制的源头。中药材是由多种化学成分构成的复杂体系,其特点是化学成分种类繁多、结构多样、含量差异大,而且化学成分的种类及其组分比例容易受到种质资源、生长环境、栽培与加工方式等多种因素的影响。原料药材质量参差不齐、缺乏严格质量控制措施,其制备而成的中药注射剂,容易出现质量不稳定及安全隐患。如黄芪注射液,其主要成分黄芪多糖因产地不同含量差别较大,产于四川的黄芪多糖含量比大兴安岭的多2倍。不同地区丹参的有效成分含量也不同,四川产的丹参中丹参素含量约为山东的3倍,而山东产的丹参中丹参酮类含量约为四川的2倍。不同光质对丹参根系有效成分含量影响显著:与同等光量子数目的白光对照相比,补充蓝光处理使丹酚酸B含量显著提高了32.39%,丹参酮ⅡA质量分数提高了12.50%。研究发现不同产地人参的总糖和还原糖含量、可溶性多糖含量存在一定差别,由此制备的人参多糖注射液必然存在明显的质量差异。
中药注射剂质量的一致性不单是中药成分的一致性,还要加强对有害物质的控制。中药注射剂的热原控制,要比化学药更复杂。除了细菌污染外,植物中药因富含糖类而更易被霉菌(真菌)污染,霉菌产物也会引起发热等不良反应,只有从严进行药材原料的质量监控,规范采收加工与贮藏,严防变质、霉变,通过生产过程质量控制方可降低此类不良反应。通常,中药注射剂生产的原料药材应直接来源于生产基地,否则,流通过程的各种不确定因素将会造成不良反应大大增加。如鱼腥草注射液的原料药材鲜鱼腥草,从种植、采收、储藏、加工、提取必须严格控制每个环节,否则可能因为发霉、变质而带来微生物和毒素等污染,影响药品质量而诱发严重的不良反应。因此需要严格控制原料的质量。在安全性检测基础上,积累安全性关联的生产要素,加以严格控制。
综上所述,原料药材是影响中药注射剂质量的重要因素之一。中药材GAP的推行解决了部分药材的来源问题,但品种有限。“注射剂用药材一般应固定品种、药用部位、产地、产地加工、采收期等”要求,在一定程度上保证了注射剂原药材的质量稳定性。正确的产地和规范化的栽培管理措施是中药质量的重要保证,固定区域内中药质量变异较小,相对均一,并且经GAP严选的道地药材种质资源,有利于提升中药注射剂的一致性与可控性。因此,强化药材质量控制,将中药注射剂原料从产地加工开始纳入质量监控体系,控制原药材的生产、种植、采收、贮藏、土壤、农药使用、重金属残留、微生物等,只有将中药材真正当作“药”来看待,中药原药材及中药注射剂的质量才有可能得到保障。
4 中药注射剂原料实施GAP管理展望
为全面提高中药注射剂的安全性、有效性和质量可控性,国家食品药品监督管理局下发了《关于开展中药注射剂安全性再评价工作的通知》(国食药监办(2009)28号)。与《中药、天然药物注射剂基本技术要求》中原料药材质量控制的建议性要求类似,《中药注射剂安全性再评价质量控制要点》对中药注射剂原料中药材实施GAP管理相关内容也提出了建议性要求。①中药注射剂的处方组成及用量应与国家标准一致。②应采取有效措施保证原料质量的稳定。应固定药材的基原、药用部位、产地、采收期、产地加工、贮存条件等,建立相对稳定的药材基地,并加强药材生产全过程的质量控制,尽可能采用规范化种植(GAP)的药材。药材标准中包含多种基原的,应固定使用其中一种基原的药材。如确需固定多个基原或产地的,应提供充分的研究资料,并保证药材质量稳定。处方中饮片的生产企业、炮制方法和条件应固定,药材来源及饮片质量应具有可追溯性,药材的要求同上。③应根据质量控制的需要,建立可控性强的注射剂用原料质量标准,完善质量控制项目,如指纹图谱、浸出物检查等,以体现原料的特点以及与制剂质量控制的相关性,保证原料的质量稳定。
中药注射剂安全性再评价已经实施多年,早已成为业界共识。但由于中药注射剂再评价缺乏可参考的经验和具体工作细则,再加之中药本身存在的复杂原因,再评价工作尚未真正落地。而且有关原料药材实施GAP管理的建议性要求法律效力低、执行力度弱,难以保障中药注射剂原料药材质量稳定、可控。中药注射剂市场规模大、产品附加值高,比较效益较高,对原料药材实施GAP认证投入产出压力小;中药注射剂原料药材用量相对较少,当前GAP基地所产药材可满足大多数中药注射剂重点品种的原料需求。可见,以中药注射剂为主体,开展中药注射剂原料GAP管理具有一定可行性。目前,一些企事业单位,如国家药品监督管理局中药监管科学研究中心、行业协会等已具有推进GAP管理及认证的相关基础条件。因此,以中药注射剂原料药为基础,探索实施中药材GAP生产管理已具备条件。
版权归属原始权利人,文中观点仅代表作者本人,不代表本平台立场。转载请标明来源。
标签:
【免责声明】
1.“高鹏说药材”致力于提供中药行业各类资讯信息,但不保证信息的合理性、准确性和完整性,且不对因信息的不合理、不准确或遗漏导致的任何损失或损害承担责任。
2.“高鹏说药材”部分文章信息来源于网络转载是出于传递更多信息之目的,并不意味着赞同其观点或证实其内容的真实性。如对内容有疑议,请及时与我平台联系。
3.“高鹏说药材”所有信息仅供参考,不做任何商业交易及或医疗服务的根据,如自行使用“高鹏说药材”内容发生偏差,我平台不承担任何责任,包括但不限于法律责任,赔偿责任。
4.“高鹏说药材”各类带“原创”标识的资讯,享有著作权及相关知识产权,未经本网站协议授权,任何媒体、网站、个人不得转载、链接或其他方式进行发布;经本网协议授权的转载或引用,必须注明“来源:高鹏说药材(www.gpsyc.com)”。违者本网站将依法追究法律责任。
5.本声明未涉及的问题参见国家有关法律法规,当本声明与国家法律法规冲突时,以国家法律法规为准。
最新文章

百花农品:真药材,平价卖,守护千年药香
在中药材电商市场蓬勃发展的当下,乱象丛生:染色虫草、硫磺枸杞...(1080 )人阅读时间:2025-02-27
破茧重生:民间中医的千年传承亟需政策松绑!
中医,作为中华文明的瑰宝,数千年来以“简、便、验、廉”的特点...(926 )人阅读时间:2025-02-25
理性看待民间中医的作用:传承与困境中的“高手在民间”
中医作为中华文明的瑰宝,其生命力不仅存在于现代医疗体系内,更...(894 )人阅读时间:2025-02-24
让真药材回归百姓家——守护中药生态,百花农品与您同行!
中药,是中国人代代相传的健康密码,承载着“治未病”的智慧与自...(1025 )人阅读时间:2025-02-21


 导读2022年9月,云南省人民政府办公厅印发《云南省“十四五...
导读2022年9月,云南省人民政府办公厅印发《云南省“十四五... 1 阿胶 药材以乌黑、光亮、断面紫红色、质脆、味甘、无腥...
1 阿胶 药材以乌黑、光亮、断面紫红色、质脆、味甘、无腥... 20种常用中药材的贮藏养护1.细辛【贮藏】置于阴凉干燥处。多...
20种常用中药材的贮藏养护1.细辛【贮藏】置于阴凉干燥处。多... 民革中央: 《关于完善野生药材资源保护管理工作的提案》收悉...
民革中央: 《关于完善野生药材资源保护管理工作的提案》收悉...


