基于“延伸检查”实施新版中药材GAP各方职责与机遇探讨
时间:2023-08-16人气:作者: 中药材种植养殖专业委员会
魏建和1,2*,王秋玲1,王文全1,乔旭1
1.中国医学科学院北京协和医学院药用植物研究所/中草药物质基础与资源利用教育部重点实验室/濒危药材繁育国家工程实验室,北京100193;
2.中国医学科学院北京协和医学院药用植物研究所海南分所/海南省南药资源保护与开发重点实验室/国家中医药管理局沉香可持续利用重点研究室,海南海口570311
[摘要]为有助于理解新发布的《中药材生产质量管理规范》(以下简称新版中药材GAP)实施的“延伸检查”方式、促进各方建设规范化生产基地、推动中药高质量发展,探讨按“延伸检查”实施新版中药材GAP中药生产企业、中药材生产企业及各相关管理部门的职责,及其带来的挑战和机遇等。新版中药材GAP既没有采取《中药材生产质量管理规范(试行)》采用的认证方式,也没有采用备案管理方式,而是采用了“延伸检查”的新方式。中药生产企业药品标签标示“药材符合GAP要求”,有责任开展原料供应商审核,省级药品监督管理部门对中药生产企业监管时可按需要延伸检查中药材生产企业,地方政府和各部门鼓励指导中药生产企业和中药材生产企业建设GAP基地。采用延伸检查实施新版中药材GAP可使中药材生产企业走上发展壮大之路,成为中药生产企业保障原料质量、生产优质药品的重要抓手,成为地方政府和中药行业管理部门发展中药材生产的有效手段,也将成为药品监督管理部门药材质量监管的有效方式。
2022年3月17日,经修订后的《中药材生产质量管理规范》(以下简称新版中药材GAP)由国家药品监督管理局、农业农村部、国家林业和草原局、国家中医药管理局联合发布。在发布的公告(2022年第22号,以下简称2022GAP公告)中,明确了新版中药材GAP的实施方式既不是认证制,也不是备案制,而是“延伸检查”制[1],即中药生产企业使用了符合新版中药材GAP要求基地生产的药材,可在药品标签适当位置标示“药材符合GAP要求”,药品监督管理部门在对中药生产企业监督检查时,如有必要,可对中药材生产企业和符合GAP的基地(以下简称GAP基地)开展“延伸检查”。国家和地方药品监督管理部门正在研究制定具体的延伸检查方案,但新版中药材GAP从2022年3月1日起施行。基于“延伸检查”的新版中药材GAP实施,中药生产企业、中药材生产企业及各相关管理部门的职责是什么,会带来什么挑战和机遇?笔者一直参与新版中药材GAP的起草工作,基于四部局发布的2022GAP公告,在此谈一些粗浅认识,以期引起更多探讨,推动新版中药材GAP落地实施,促进中药高质量发展。
1 2022GAP公告明确了新版中药材GAP实施的新方式
此次国家药品监督管理局、农业农村部、国家林业和草原局、国家中医药管理局联合发布新版中药材GAP的同时,采用公告的方式明确了新版中药材GAP的实施方式为“延伸检查”。这是一种新的方式,既不同于《中药材生产质量管理规范(试行)》(以下简称试行版中药材GAP)实施采用的认证检查方式(“认证制”),也没有采用2016年原国家食品药品监督管理总局公告时提及的备案管理方式(“备案制”)[2]。
1.1试行版中药材GAP实施方式采用的是国家药监部门组织的认证管理方式
试行版中药材GAP于2002年3月18日经国家药品监督管理局局务会审议通过,2002年4月17日以国家药品监督管理局令第32号发布,并于2002年6月1日起施行[3]。为推动规范的落地,基于当时的国家行政事项管理许可特点及GAP的非强制性,国家药品监督管理部门经研究决定采取认证管理的方式实施GAP。为此,2003年9月19日,原国家食品药品监督管理局以国食药监安〔2003〕251号文印发了《关于印发〈中药材生产质量管理规范认证管理办法(试行)〉及〈中药材GAP认证检查评定标准(试行)〉的通知》[4]。自2003年11月1日起,由原国家食品药品监督管理局正式受理中药材GAP的认证申请,并组织认证试点工作。认证通过的基地在国家药品监督管理部门的网站上进行公布,同时也开展了一些基地复认证工作。截至2016年认证工作取消,先后共认证中药材GAP基地177个,涉及全国26个省份的110家企业71种中药材。因此,2003—2016年,试行版中药材GAP的实施方式采用的是行政气息较浓厚的“认证制”,且由国家药品监督管理部门直接认证,地方药品监督管理部门给予配合。
1.2新版中药材GAP曾考虑采用备案管理的实施方式
2016年2月3日,国务院印发《关于取消13项国务院部门行政许可事项的决定》,取消了GAP认证[5]。基于此,2016年3月18日,为适应国家政府职能转变的改革、落实国务院要求,原国家食品药品监督管理总局发布了《关于取消中药材生产质量管理规范认证有关事宜的公告》(2016年第72号),公告“一、自公告发布之日起,国家食品药品监督管理总局不再开展中药材GAP认证工作,不再审理相关申请。二、国家食品药品监督管理总局将继续做好取消认证后中药材GAP的监督实施工作,对中药材GAP实施备案管理,具体办法另行制定。三、已经通过认证的中药材生产企业应继续按照中药材GAP规定,切实加强全过程质量管理,保证持续合规。食品药品监督管理部门要加强中药材GAP的监督检查,发现问题依法依规处理,保证中药材质量”[2]。该公告明确的3点,一是正式取消了中药材GAP的认证工作;二是中药材GAP实施方式拟改为备案管理,但未出台相应的具体办法;三是并没有废止试行版中药材GAP,原有认证的基地继续管理。该公告发布后,很多人认为中药材GAP被取消了。实际上,这是一种误解,取消的是中药材GAP基地的认证工作,而不是GAP本身。
在2018年,国家市场监督管理总局发布《中药材生产质量管理规范(修订草案征求意见稿)》[6],在其同时发布的“起草说明”中也提及修订的GAP拟采用备案管理的方式。因此,在取消了GAP认证工作后,国家监督管理部门研究过GAP的实施方式拟采用备案管理方式,但当时正在修订的新版中药材GAP尚未定稿发布,因此实施方式也未确定。
1.3新版中药材GAP采用新的实施方式——“延伸检查”
此次在发布新版中药材GAP同时,国家药品监督管理局等通过公告方式同步明确了新版中药材GAP的实施方式为“延伸检查”。2022GAP公告中有2处提及“延伸检查”:一是“省级药品监督管理部门……必要时对相应的中药材生产企业开展延伸检查,重点检查是否符合本规范。发现不符合的,应当依法严厉查处,责令中药生产企业限期改正、取消标示等,并公开相应的中药材生产企业及其中药材品种,通报中药材产地人民政府”;二是“药品监督管理部门对相应的中药材生产企业开展延伸检查,做好药用要求、产地加工、质量检验等指导”[1]。
2022GAP公告明确延伸检查由省级药品监督管理部门实施而不是直接由国家药品监督管理部门实施。“延伸检查”的对象是中药生产企业药品标示了“药材符合GAP要求”来源的中药材生产企业。延伸检查的主要目的是检查中药材生产企业及其基地的管理是否符合新版中药材GAP的要求。
目前,国家药品监督管理局等依据新版中药材GAP条款主要内容,尤其是禁止性条款和“应当”达到要求的条款,正研究具体的延伸检查管理办法。新版中药材GAP及延伸检查管理办法是中药材生产企业规范化生产的技术指导原则,是中药生产企业供应商质量审核的技术标准,也是药品监督管理部门GAP延伸检查的技术依据。
2 基于“延伸检查”实施新版中药材GAP各方职责与挑战
“延伸检查”是一种市场导向的监管方式,将有可能解决长期以来中药材生产质量监管的难题,也有可能克服之前“认证制”带来的一些被诟病的问题。“延伸检查”的中药材GAP实施新方式既为中药生产企业、中药材生产企业带来了良好发展机遇,也带来了新的挑战。
根据2022GAP公告内容,总结了新版中药材GAP推进各方的职责(图1)。2022GAP公告较清晰地区分了国家相关部门与地方政府、地方各相关部门的职责与权益,也明确了中药生产企业、中药材生产企业的职责与权益。
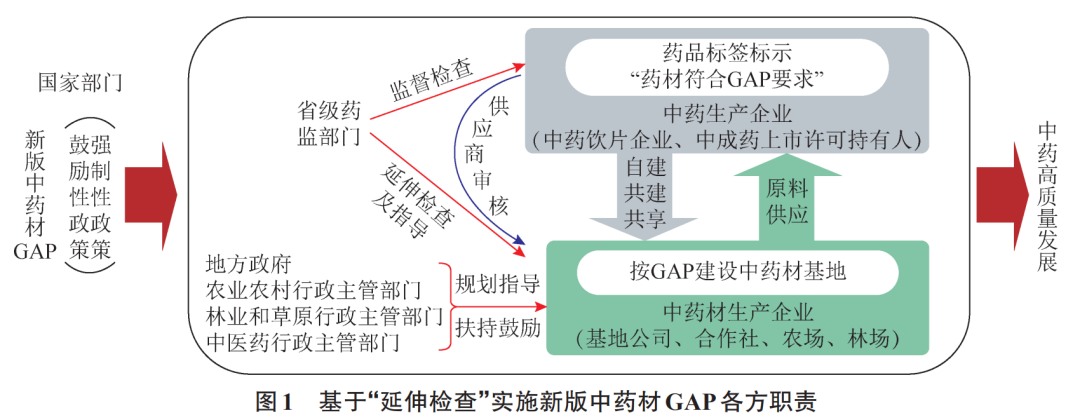
2.1国家相关部门
国家相关部门是推动中药材GAP的主导力量。制定和修订中药材GAP,制定推动规范实施的各项监管和鼓励性的政策措施,明确各方的职责。后续将制定延伸检查管理办法,指导制定新版中药材GAP实施技术指南。根据基地建设进展和符合GAP的药材(以下简称GAP药材)供应情况,研究制定鼓励性或强制性的可促使中药生产企业使用GAP药材的相关措施。
2.2中药生产企业
中药生产企业是使用GAP药材的主体,也是带动GAP基地建设的核心力量。只有中药生产企业大量需求和使用GAP药材,才能带动GAP基地建设。为此,2022GAP公告明确如果原料药材来自GAP基地,中药生产企业可以在相应饮片、配方颗粒的包装上标示“药材符合GAP要求”;如果中药复方制剂所有“处方成份”均来自GAP基地,也可标示;如果只有部分“处方成份”来自GAP基地,尚不能标示。中药生产企业需接受药品监督管理部门的监督检查,药品如标示了“药材符合GAP要求”,需要对相应的中药材生产企业进行“供应商审核”,保证符合要求,同时积极协助药品监督管理部门开展延伸检查。国家鼓励中药生产企业采取各种方式自建、共建、共享中药材GAP基地。
2.3中药材生产企业
中药材生产企业是实施新版中药材GAP、建设中药材GAP基地的主体。中药材生产企业供应GAP药材时,需接受中药生产企业的“供应商审核”,也需要接受相应的省级药品监督管理部门的“延伸检查”。中药材生产企业采用的组织方式可以灵活多样,如公司+基地、合作社、农场、林场方式。中药材生产企业按照新版中药材GAP的要求,建设规范化生产基地,生产出GAP药材,供应给中药生产企业,既可只供应1家也可供应多家。
2.4省级药品监督管理部门
根据2022GAP公告,省级药品监督管理部门是“延伸检查”的主体,对应当使用或标示了“药材符合GAP要求”的中药生产企业,要加强“监督检查”,必要时对相应的中药材生产企业开展“延伸检查”,重点检查是否符合新版中药材GAP。发现不符合的,应当依法严厉查处,责令中药生产企业限期改正、取消标示等,并公开相应的中药材生产企业及其中药材品种,通报中药材产地人民政府。除了做好“监督检查”和“延伸检查”外,也要做好药用要求、产地加工、质量检验等指导。
2.5地方人民政府各相关管理部门
2022GAP公告明确,各省相关管理部门应做好2件工作:一是在省委、省政府领导下,配合和协助中药材产地人民政府做好中药材规范化发展工作,如完善中药材产业高质量发展工作机制、制定中药材产业发展规划、细化推进中药材规范化发展的激励政策、建立中药材生产企业及其生产基地台账和信用档案、实施动态监管、建立中药材规范化生产追溯信息化平台等,鼓励中药材规范化、集约化生产基础较好的省份结合本辖区中药材发展实际,研究制定实施细则,积极探索推进。二是依职责对新版中药材GAP的实施和推进进行检查和技术指导。农业农村行政主管部门牵头做好中药材种子种苗及种源提供、田间管理、农药和肥料使用、病虫害防治等指导;林业和草原行政主管部门牵头做好中药材生态种植、野生抚育、仿野生栽培,以及属于濒危管理范畴的中药材种植、养殖等指导;中医药行政主管部门协同做好中药材种子种苗、规范种植、采收加工及生态种植等指导。2022GAP公告还提出,各部门要协作,形成合力,强化宣传培训,如发现有重大问题或重大政策建议,及时报国家相应部门。
3 基于“延伸检查”实施新版中药材GAP各方的发展机遇
新版中药材GAP实施采用“延伸检查”方式,在带来各种挑战的同时,也带来管理调整和产业发展的新机遇(图2)。
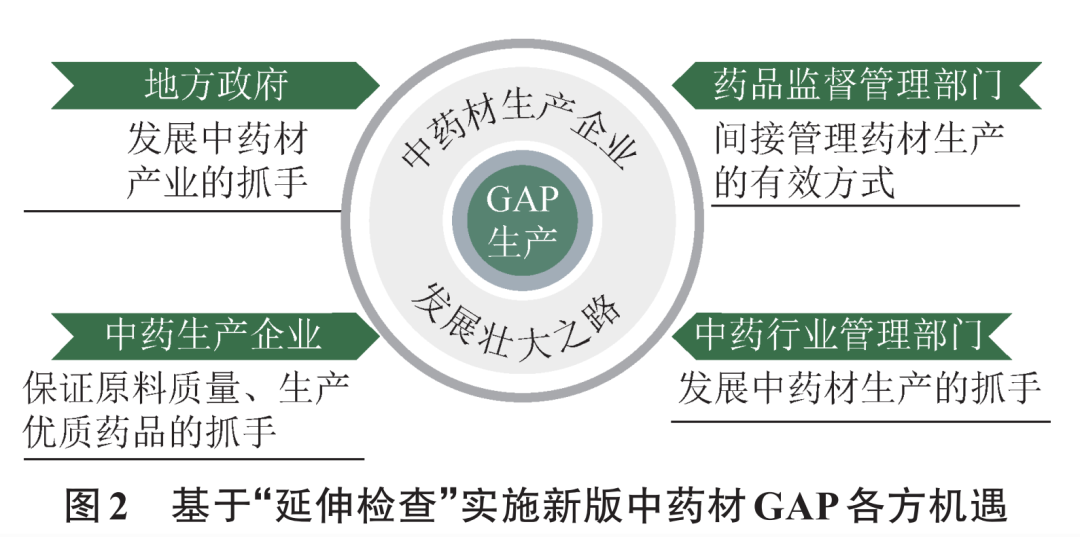
3.1中药材生产企业发展壮大之路
建设中药材GAP基地将成为中药材生产企业优选之路。如果建成符合新版中药材GAP要求的规范化生产基地,且建有持续稳定的质量管理体系,保证基地药材价格和质量可控,则中药材生产企业基地的GAP药材将广受饮片企业、配方颗粒企业和中成药企业等欢迎。使用GAP药材作为原料,中药生产企业的药品标签可标示“药材符合GAP要求”,这是象征质量和品牌的“标签”。新的“延伸检查”+“标示”方式,为“优质优先”提供了路径,也为将来的“优质优价”提供了可能。
3.2中药生产企业保证原料质量、生产优质药品的抓手
药品标签标示“药材符合GAP要求”,将助推一批中药生产企业和中药产品脱颖而出。中药生产企业通过自己或合作建设中药材GAP基地,或采购GAP基地的药材,通过建立“供应商审核”机制,确保来自GAP基地的药材生产与质量均符合新版中药材GAP的要求;药品标签可标示“药材符合GAP要求”,可将其产品与其他企业的同类产品区分,成为质量和品牌的象征。
3.3地方政府发展中药材产业的抓手
建成GAP基地可成为地方发展中药材产业的可行之路。GAP基地的药材将有中药生产企业优先采购,有中药生产企业指导生产和质量控制管理,还有国家的“延伸检查”督促基地质量建设管理,因此,地方政府按新版中药材GAP发展中药材生产可作为推动地方产业发展、乡村振兴的重要举措。
3.4中药行业管理部门发展中药材生产的抓手
基于“延伸检查”的实施方式,基地建设的质量管理体系将在中药材生产企业和中药生产企业之间形成良好的互动和制约模式。中药生产企业和中药材生产企业均有发展中药材规范化生产基地的内在驱动力,因此,国家和地方的管理部门发展中药材生产的成效会更加显著,也可超脱于基地发展本身,更多关注制定可以促使中药生产企业使用GAP药材的强制性或鼓励性措施,以及降低中药材生产企业生产成本的措施。
3.5药品监督管理部门间接管理药材生产的有效方式
药品监督管理部门一直面临药材生产质量监管的“两难”境地。一方面,中药材质量是影响中药饮片和中成药质量的关键因素之一,因此,药品质量监管必须关注中药材生产质量;另一方面,数百种常用中药材的生产主体较为分散,药品监督管理部门现有力量难以实现全面监管。试行版中药材GAP采用“认证”实施方式,认证后的GAP基地相当于得到了国家监督管理部门的认可,监管力量必须保证基地生产符合GAP要求,责任重大。
新版中药材GAP采用“延伸检查”的实施方式,为破解中药材生产质量监管难题提供了解决方案。药品监督管理部门重点工作可放在监管中药生产企业原料情况,通过对其监督检查,可督促中药生产企业审计药材供应商的原料质量、指导中药材生产企业的GAP基地建设。而对中药材生产基地的监管,则可以根据中药生产企业原料质量监管情况,适当延伸检查中药材生产企业。中药材生产企业为了给中药生产企业持续供应符合GAP要求的原料药材,会自觉按照新版中药材GAP管理生产基地;地方政府为了地方中药农业能有机地融入中药工业,也会强化措施促进GAP基地的建设。通过“延伸检查”这一新的实施方式,可充分调动各方的“内生”动力,极大缓解监管压力。
4 总结与展望
新版中药材GAP采用了新的实施方式——“延伸检查”,有别于业界熟悉的“认证”方式,也不是“备案管理”。“延伸检查”对中药材生产企业而言较陌生,对中药生产企业而言责任更大。但该方式符合我国中药材生产的现实情况,也符合当前我国药品监管和行业发展的特点。对中药材基地、中药材生产企业和中药生产企业而言,实施新版中药材GAP、建设规范化生产基地更多的不是挑战,而是重大发展机遇,是树立“质量品牌”的可行抓手;对致力于发展中药材产业、助力乡村振兴的地方政府而言,建设GAP基地也是切实可行的抓手;对行业和监督管理部门而言,探索管理模式转变、强有力地推进GAP基地建设,是中药高质量发展的有力抓手。
标签:
【免责声明】
1.“高鹏说药材”致力于提供中药行业各类资讯信息,但不保证信息的合理性、准确性和完整性,且不对因信息的不合理、不准确或遗漏导致的任何损失或损害承担责任。
2.“高鹏说药材”部分文章信息来源于网络转载是出于传递更多信息之目的,并不意味着赞同其观点或证实其内容的真实性。如对内容有疑议,请及时与我平台联系。
3.“高鹏说药材”所有信息仅供参考,不做任何商业交易及或医疗服务的根据,如自行使用“高鹏说药材”内容发生偏差,我平台不承担任何责任,包括但不限于法律责任,赔偿责任。
4.“高鹏说药材”各类带“原创”标识的资讯,享有著作权及相关知识产权,未经本网站协议授权,任何媒体、网站、个人不得转载、链接或其他方式进行发布;经本网协议授权的转载或引用,必须注明“来源:高鹏说药材(www.gpsyc.com)”。违者本网站将依法追究法律责任。
5.本声明未涉及的问题参见国家有关法律法规,当本声明与国家法律法规冲突时,以国家法律法规为准。
最新文章

百花农品:真药材,平价卖,守护千年药香
在中药材电商市场蓬勃发展的当下,乱象丛生:染色虫草、硫磺枸杞...(1080 )人阅读时间:2025-02-27
破茧重生:民间中医的千年传承亟需政策松绑!
中医,作为中华文明的瑰宝,数千年来以“简、便、验、廉”的特点...(926 )人阅读时间:2025-02-25
理性看待民间中医的作用:传承与困境中的“高手在民间”
中医作为中华文明的瑰宝,其生命力不仅存在于现代医疗体系内,更...(894 )人阅读时间:2025-02-24
让真药材回归百姓家——守护中药生态,百花农品与您同行!
中药,是中国人代代相传的健康密码,承载着“治未病”的智慧与自...(1025 )人阅读时间:2025-02-21


 全国22个省市中药材趁鲜切制品种目录(截至2023年10月9...
全国22个省市中药材趁鲜切制品种目录(截至2023年10月9... 中药材质量追溯监管的问题与对策随着时代和科技的进步,中医药行...
中药材质量追溯监管的问题与对策随着时代和科技的进步,中医药行... 来源:《云南化工》2022,49(11)常用中药材鉴别方法的...
来源:《云南化工》2022,49(11)常用中药材鉴别方法的... 植物生长调节剂在中药材种植方面的应用现状及其对中药材质量和产...
植物生长调节剂在中药材种植方面的应用现状及其对中药材质量和产...


