正确引用中药材标准 保证中药新药质量源头控制——我国中药材质量标准现状及相关问题探讨
时间:2023-08-16人气:作者: 中药材种植养殖专业委员会
我国中药材标准现状
中药材国家标准包括《中华人民共和国药典》(以下简称《中国药典》)、部颁或局颁标准(包括进口药材标准和新药材标准)。
中国药典
自1963年至2020年,除1977年版外,历版《中国药典》所收载的中药材标准数量呈逐渐增加趋势。在《中国药典》制修订过程中,凡现行版收载的,相应历版《中国药典》、局(部)颁标准废止;凡现行版未收载的,仍执行相应历版《中国药典》、局(部)颁标准,但应符合现行版《中国药典》的相关通用技术要求;经上市后评价撤销或注销的品种,相应历版《中国药典》、局(部)颁标准废止。目前,历版《中国药典》所收载的有效药材标准共819个(不包括增补本),《中国药典》已成为新药研究用中药材引用标准的主体,在推动中药材标准质量控制水平提高方面起到了积极推动和示范作用。
部颁标准
1992年,原卫生部发布了《中华人民共和国卫生部药品标准·中药材》第一册,收载101种中药材标准,经与《中国药典》2020年版比对,其中药典收载品种之外的标准有50余种。1995年至1998年,为了满足民族药用药需求,原卫生部发布了《中华人民共和国卫生部药品标准·藏药》第一册、《中华人民共和国卫生部药品标准·蒙药分册》和《中华人民共和国卫生部药品标准·维吾尔药分册》,分别收载藏药材136种、蒙药材57种和维吾尔药材115种;经与《中国药典》2020年版比对,其中药典药材品种之外的标准分别为110余种、50余种和100余种。
进口药材标准
进口药材是我国中药材资源的重要组成之一,从1960年《进口药材标准规格资料》到2004年发布的《儿茶等43种进口药材标准》,发布进口药材标准共257个品次,再加上1988年到1993年间发布的5个单行版标准,截至2019年,我国共发布进口药材标准262个品次。2012—2015年间,国家组织就部分进口药材标准进行修订,其中,与《中国药典》基原相同且已完成修订的品种收入《中国药典》,不再单列进口药材标准;而《中国药典》未收载或基原不同的品种则继续保留进口药材标准。2019年,国家市场监督管理总局发布《进口药材管理办法》,明确了“进口的药材应当符合国家药品标准。《中国药典》现行版未收载的品种,应当执行进口药材标准;《中国药典》现行版、进口药材标准均未收载的品种,应当执行其他的国家药品标准。少数民族地区进口当地习用的少数民族药药材,尚无国家药品标准的,应当符合相应的省、自治区药材标准”。
新药材标准
自1985年《新药审批办法》实施以来,新的中药材及其制剂一直都是中药新药的一个类别,对中药新资源的开发利用起到重要作用。批准的新药材有塞隆骨、人工牛黄、熊胆粉等。
地区性民间习用药材标准
1987年,原卫生部发布《地区性民间习用药材管理办法(试行)》后,各省、自治区、直辖市药品管理部门大多发布了各自的地区性民间习用药材标准,并不断修订。其中,有成册的地方药品标准、地区性民间习用药材标准等,还有各省(区、市)以文件形式发布的单页标准,收载情况较为复杂。2015年,原国家食品药品监督管理总局发布《关于加强地方药材标准管理有关事宜的通知》后,各省(区、市)逐步开展地区性民间习用药材标准的修订及规范工作。部分省份发布了地区性民间习用药材标准的发布、废止或更名公告。地区性民间习用药材标准为各省份自行发布,由于发布时间、地区使用习惯等的不同,在药材标准中存在“同名异物”“同物异名”等现象。
中药材标准引用存在的问题
由于我国中药材标准的发布主体多样,发布时间跨度较大,使用区域较为分散,给中药新药用中药材标准的引用带来一些问题。
基原或药用部位不统一
由于我国中药材标准制定的时间跨度较大,地域分布较宽,且缺少完整、动态更新的中药材标准检索系统,给准确引用中药材标准带来一定困难。在我国中药材标准中存在同名异物、同物异名等现象。虽然根据《地区性民间习用药材管理办法(试行)》,“经省、自治区、直辖市卫生厅(局)审核批准的地区性民间习用药材,只准在本地区内销售使用”。但是在现实中,地区性民间习用药材存在跨省流通的情况,同名异物、同物异名问题可能会导致中药材基原混乱。
部分药材标准的可控性较低
虽然经过逐步修订再版,地区性民间习用药材标准的质量可控性逐步提升,但目前仍有不少地区性民间习用药材标准仅收载有性状、检查等项目,难以有效控制中药材质量。仅根据药材标准进行检验,难以准确鉴别基原真伪、质量优劣,给一些毒性中药材的安全用药带来隐患。
曲剂、提取物等的质量差异较大
曲剂系指药材经发酵处理而制成的块状或颗粒状制剂。从该定义看,曲剂是制剂,不是中药材。但是,由于历史等原因,仍有部分曲剂列入地区性民间习用药材标准。由于不同省份中药材标准收载的同一种曲剂的处方、制法等可能不同,其质量差异可能较大。
提取物是中药材标准中收载的一种特殊类型,提取物目前尚无公认的定义,在不同情况下其准确内涵与外延可能不同。由于中药提取物大多经过较为复杂的加工处理,其所用药材基原及质量、生产工艺等对提取物的质量影响较大。
加工品也是中药材标准收载的一种特殊类型。与提取物相似,加工品的质量也会受到多种因素的影响。
恰当引用中药材标准的基本原则
由于种种原因,我国中药材标准的总体情况较为复杂。在中药新药研究与申报过程中应关注中药材标准的发展动态及合规性,恰当引用中药材标准。建议中药新药用中药材标准引用的基本原则如下。
以临床为导向
来源于临床经验方的中药新药,应关注已有人用经验的临床实践所用药材的实际基原及药用部位,关注药材的实际产地及临床使用地区当时所执行的中药材标准的版本,避免因错误引用不同地区或版本的中药材标准而导致的中药新药用药材的基原或药用部位与临床实际应用不同。
国家标准优先
相对于地区性民间习用药材标准,建议优先引用国家标准;在国家标准中,建议优先引用《中国药典》标准。
同省份标准时间优先
应注意引用最新版本的中药材标准,同一个省份以最新的标准为准;关注各省(区、市)药监局网站发布的地区性民间习用药材标准发布、废止或更名公告。
不同省份标准质控水平优先
当某个药材同时收载于多个不同省份的药材标准时,建议优先引用质控水平较高的药材标准。
引用与提高相结合
在准确引用基原、药用部位及产地加工方法等与临床用药材相同的前提下,还需借鉴同一药材的其他标准中所收载的合理质控方法,按照中药新药研究用药材质控的相关要求,研究建立和完善中药新药用内控药材标准。
声明:本文来源于中国医药报。
标签:
【免责声明】
1.“高鹏说药材”致力于提供中药行业各类资讯信息,但不保证信息的合理性、准确性和完整性,且不对因信息的不合理、不准确或遗漏导致的任何损失或损害承担责任。
2.“高鹏说药材”部分文章信息来源于网络转载是出于传递更多信息之目的,并不意味着赞同其观点或证实其内容的真实性。如对内容有疑议,请及时与我平台联系。
3.“高鹏说药材”所有信息仅供参考,不做任何商业交易及或医疗服务的根据,如自行使用“高鹏说药材”内容发生偏差,我平台不承担任何责任,包括但不限于法律责任,赔偿责任。
4.“高鹏说药材”各类带“原创”标识的资讯,享有著作权及相关知识产权,未经本网站协议授权,任何媒体、网站、个人不得转载、链接或其他方式进行发布;经本网协议授权的转载或引用,必须注明“来源:高鹏说药材(www.gpsyc.com)”。违者本网站将依法追究法律责任。
5.本声明未涉及的问题参见国家有关法律法规,当本声明与国家法律法规冲突时,以国家法律法规为准。
最新文章

百花农品:真药材,平价卖,守护千年药香
在中药材电商市场蓬勃发展的当下,乱象丛生:染色虫草、硫磺枸杞...(1080 )人阅读时间:2025-02-27
破茧重生:民间中医的千年传承亟需政策松绑!
中医,作为中华文明的瑰宝,数千年来以“简、便、验、廉”的特点...(926 )人阅读时间:2025-02-25
理性看待民间中医的作用:传承与困境中的“高手在民间”
中医作为中华文明的瑰宝,其生命力不仅存在于现代医疗体系内,更...(894 )人阅读时间:2025-02-24
让真药材回归百姓家——守护中药生态,百花农品与您同行!
中药,是中国人代代相传的健康密码,承载着“治未病”的智慧与自...(1025 )人阅读时间:2025-02-21


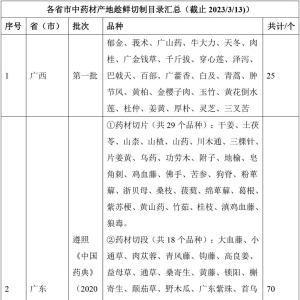 品种汇总来源:大品种联盟
品种汇总来源:大品种联盟 中药材定向培育分析评估系统的设计与实现孙成忠1,王文全2 通...
中药材定向培育分析评估系统的设计与实现孙成忠1,王文全2 通... 中药材种业发展现状及品牌化战略路径王继永,王浩,曾燕,史玉宝...
中药材种业发展现状及品牌化战略路径王继永,王浩,曾燕,史玉宝... 由于各地天气等自然环境不同,中药材的采收时间存在差异,加工方...
由于各地天气等自然环境不同,中药材的采收时间存在差异,加工方...


