生产场地变更,比较新旧场地生产设备情况需要提交哪些资料?
时间:2023-09-05人气:作者: 蒲公英
转自:江苏省药监局审评中心

问:药品上市后生产场地变更,比较新旧场地生产设备情况需要提交哪些资料?
答:
(1)变更前后生产设备的生产厂家及型号、材质、关键技术参数、设备原理等资料;
(2)基于设备的性能、关键技术参数等对比,通过批生产和/或工艺验证情况来证明生产设备与生产工艺的匹配性;
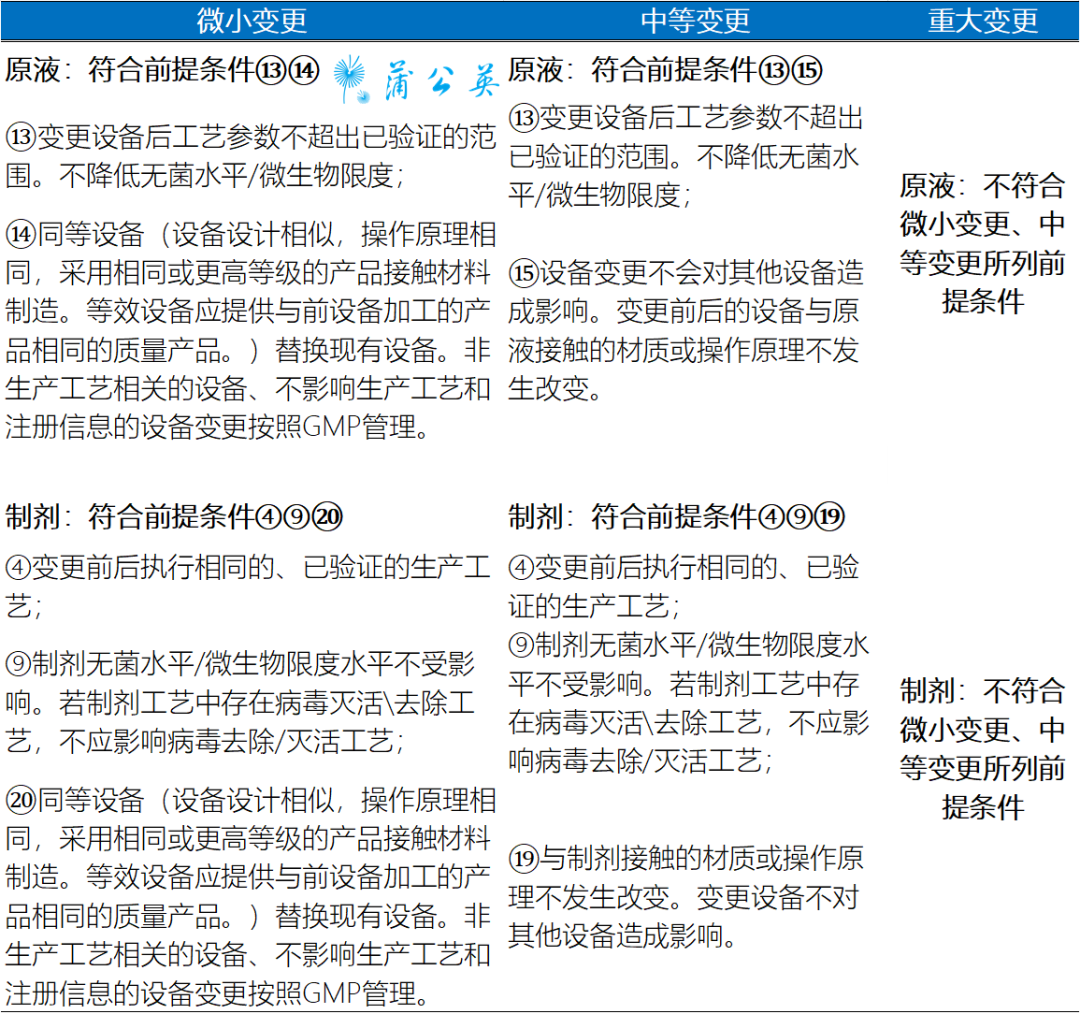
(3)按照相关药学变更研究技术指导原则要求,对设备变更管理类别进行评估,指导原则提到的变更情形包括:
①《已上市化学药品药学变更研究技术指导原则(试行)》

注:CDE于2017年发布的《已上市化学药品生产工艺变更研究技术指导原则》对于上市后变更生产设备有更为详细的分类表述,如延长总冻干时间的冻干设备的替换或增加为重大变更。
②《已上市中药药学变更研究技术指导原则(试行)》规定生产设备的选择应符合生产工艺的要求,应树立生产设备是为药品质量服务的理念,充分考虑生产设备工作原理、设备的适用性,以及可能引起的变化,评估生产设备的改变对药品质量的影响。

③《已上市生物制品药学变更研究技术指导原则(试行)》
标签:
【免责声明】
1.“高鹏说药材”致力于提供中药行业各类资讯信息,但不保证信息的合理性、准确性和完整性,且不对因信息的不合理、不准确或遗漏导致的任何损失或损害承担责任。
2.“高鹏说药材”部分文章信息来源于网络转载是出于传递更多信息之目的,并不意味着赞同其观点或证实其内容的真实性。如对内容有疑议,请及时与我平台联系。
3.“高鹏说药材”所有信息仅供参考,不做任何商业交易及或医疗服务的根据,如自行使用“高鹏说药材”内容发生偏差,我平台不承担任何责任,包括但不限于法律责任,赔偿责任。
4.“高鹏说药材”各类带“原创”标识的资讯,享有著作权及相关知识产权,未经本网站协议授权,任何媒体、网站、个人不得转载、链接或其他方式进行发布;经本网协议授权的转载或引用,必须注明“来源:高鹏说药材(www.gpsyc.com)”。违者本网站将依法追究法律责任。
5.本声明未涉及的问题参见国家有关法律法规,当本声明与国家法律法规冲突时,以国家法律法规为准。
最新文章

百花农品:真药材,平价卖,守护千年药香
在中药材电商市场蓬勃发展的当下,乱象丛生:染色虫草、硫磺枸杞...(1080 )人阅读时间:2025-02-27
破茧重生:民间中医的千年传承亟需政策松绑!
中医,作为中华文明的瑰宝,数千年来以“简、便、验、廉”的特点...(926 )人阅读时间:2025-02-25
理性看待民间中医的作用:传承与困境中的“高手在民间”
中医作为中华文明的瑰宝,其生命力不仅存在于现代医疗体系内,更...(894 )人阅读时间:2025-02-24
让真药材回归百姓家——守护中药生态,百花农品与您同行!
中药,是中国人代代相传的健康密码,承载着“治未病”的智慧与自...(1025 )人阅读时间:2025-02-21


 1、问题:请问药店经营如酒乌梢蛇、金钱白花蛇、蛤蚧等动物类中...
1、问题:请问药店经营如酒乌梢蛇、金钱白花蛇、蛤蚧等动物类中... 全国首届中药材产地加工大会暨中药材产业助力乡村振兴活动专家报...
全国首届中药材产地加工大会暨中药材产业助力乡村振兴活动专家报... 国中医药提字〔2023〕102号司富春代表: 您提出的关于...
国中医药提字〔2023〕102号司富春代表: 您提出的关于... 导语:新版中药材GAP已发布一年,但具体应该如何实施?相关主...
导语:新版中药材GAP已发布一年,但具体应该如何实施?相关主...


