【出海进展】5药品分别出口FDA、以色列和巴基斯坦
时间:2023-10-15人气:作者: 蒲公英
近日,三药企分别发布了产品海外上市进展公告,具体为人福医药制剂品种加巴喷丁片获得FDA暂定批准文号、普利药业注射用阿奇霉素获以色列上市许可、普利药业碘帕醇注射液获FDA上市许可、汇宇药业注射用阿扎胞苷和盐酸多柔比星注射液获巴基斯坦上市许可。
药品名称:Gabapentin Tablets (Once-Daily)(加巴喷丁片) 由于原研药“Gralise”仍处在专利保护期,
此ANDA获得美国FDA暂定批准。 加巴喷丁片用于治疗带状疱疹感染后神经痛。宜昌人福药业美国公司于2022年向FDA递交该ANDA申请,截至目前累计研发投入约为1,500万元人民币。根据数据统计,2022年该药品的原研药“Gralise”在美国市场的总销售额约为9,000万美元,原研药属于Almatica”。目前除Almatica外,Teva、Incepta、
PAR、Zydus已获暂定批准文号。Almatica目前尚持有加巴喷丁片的一项专利,将于2024年2月26日到期,待该专利到期并且FDA正式批准后,宜昌人福药业美国方可在美国上市销售本次获得ANDA批准文号的加巴喷丁片。(五)适应症:适用于敏感病原菌所致的下列感染:1、社区获得性肺炎;2、
盆腔炎性疾病。化合物阿奇霉素(Azithromycin)最初由 Pliva 研发团队发现和研制。1986年,Pliva 与 Pfizer(辉瑞)签署授权协议,Pfizer 获得西欧和美国的独家市场销售权,1997年辉瑞注射用阿奇霉素(商品名为 ZITHROMAX)在美国获准上市,
2007年进口原研(商品名:希舒美)在国内获准上市。注射用阿奇霉素目前已
经在全球广泛上市销售。公司注射用阿奇霉素完成技术研发后,逐步向国内外多个市场提交了产品的上市申请,目前获得的批准情况如下:- 2017年7月获得国家食品药品监督管理总局签发的注册批件;
- 2018年5月通过中国化学仿制药质量与疗效一致性评价;
2018年10月以来逐步获得了美国、荷兰、奥地利、德国、加拿大、澳大利亚、马来西亚、泰国、新西兰、白俄罗斯、新加坡等多个国家的批准,并于近
日在以色列获得批准。(二)适应症:本品用于整个心血管系统的血管造影,包括脑和外周动脉造
影、冠状动脉造影和脑室造影、小儿心血管造影、选择性内脏动脉造影和主动脉
造影、外周静脉造影(静脉造影),成人和小儿静脉排性尿路造影,以及成人和小儿静脉计算机断层扫描(CECT)头部和身体成像的对比增强造影。 碘帕醇(Iopamidol)最早由博莱科(Bracco)开发的非离子、低渗透碘化造影剂,它广泛应用于各种腰椎和颈椎脊髓造影、CT和 CT增强等诊断领域。碘帕醇注射液最早于1981年5月在法国批准上市,此后,陆续在欧洲其他国家批准上市,包括意大利、德国、荷兰、英国等,于1985年12月在美国批准上市,
于2002年7月在中国获批上市。碘帕醇注射液为公司开发的第一个造影剂仿制药,有鞘内和血管内两种给药途径。公司成功研发碘帕醇注射液仿制药后,分别递交欧洲、美国和中国的仿制
药注册申请,属于共线产品。碘帕醇注射液鞘内给药已于2022年5月在荷兰获
批上市,于2023年2月在美国获批上市,于2023年3月在中国获批上市。适应症:骨髓增生异常综合征,慢性粒单核细胞白血病,急性髓性白血申请人:Seacross Pharmaceuticals Ltd.适应症:适用于乳腺癌、肉瘤、肺小细胞癌、霍奇金病或非霍奇金淋巴瘤、急性白血病、甲状腺癌、膀胱癌、卵巢癌、小儿肿瘤,如神经母细胞瘤。该产品常与其他细胞毒性药物联合用于化疗方案。申请人:Seacross Pharmaceuticals Ltd.上市许可号:10mg/5ml:114255;50mg/25ml:114256;注射用阿扎胞苷是胞嘧啶核苷类似物,通过引起DNA去甲基化和对骨髓中异常造血细胞的直接细胞毒作用而产生抗肿瘤作用。适用于国际预后评分系统
(IPSS)中的中危-2 及高危骨髓增生异常综合征(MDS);慢性粒-单核细胞白血病(CMML);按照世界卫生组织(WHO)分类的急性髓系白血病(AML)、骨髓原始细胞为20~30%伴多系发育异常。公司注射用阿扎胞苷研发成功后已进行了多国注册申报,分别已在中国、英
国、德国、芬兰、巴勒斯坦等13个中欧北美市场获得上市许可。截至目前,公司已在包含中国香港、菲律宾、越南等11个国家提交注册申请。盐酸多柔比星注射液适用于乳腺癌、肉瘤、肺小细胞癌、霍奇金病或非霍奇金淋巴瘤、急性白血病、甲状腺癌、膀胱癌、卵巢癌、小儿肿瘤,如神经母细胞瘤。该产品常与其他细胞毒性药物联合用于化疗方案。公司盐酸多柔比星注射液研发成功后已进行了多国注册申报,分别已在中国、英国、孟加拉国、巴勒斯坦等8个中欧北美市场获得上市许可。截至目前,公司已在包含中国香港、菲律宾、越南等9个国家提交注册申请。
标签:
【免责声明】
1.“高鹏说药材”致力于提供中药行业各类资讯信息,但不保证信息的合理性、准确性和完整性,且不对因信息的不合理、不准确或遗漏导致的任何损失或损害承担责任。
2.“高鹏说药材”部分文章信息来源于网络转载是出于传递更多信息之目的,并不意味着赞同其观点或证实其内容的真实性。如对内容有疑议,请及时与我平台联系。
3.“高鹏说药材”所有信息仅供参考,不做任何商业交易及或医疗服务的根据,如自行使用“高鹏说药材”内容发生偏差,我平台不承担任何责任,包括但不限于法律责任,赔偿责任。
4.“高鹏说药材”各类带“原创”标识的资讯,享有著作权及相关知识产权,未经本网站协议授权,任何媒体、网站、个人不得转载、链接或其他方式进行发布;经本网协议授权的转载或引用,必须注明“来源:高鹏说药材(www.gpsyc.com)”。违者本网站将依法追究法律责任。
5.本声明未涉及的问题参见国家有关法律法规,当本声明与国家法律法规冲突时,以国家法律法规为准。










 米内网最新预测数据显示,2022E中国城市实体药店终端中成药...
米内网最新预测数据显示,2022E中国城市实体药店终端中成药...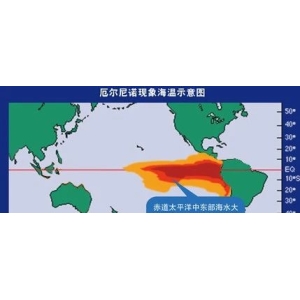 来源:中国新闻网连日来,多地出现持续的高温天气,有关专家对此...
来源:中国新闻网连日来,多地出现持续的高温天气,有关专家对此...
 各省、自治区、直辖市中医药主管部门、药品监督管理部门:为贯彻...
各省、自治区、直辖市中医药主管部门、药品监督管理部门:为贯彻...




