国家药典委公示11个药用辅料标准草案
时间:2024-02-20人气:作者: 蒲公英
转自:国家药典委
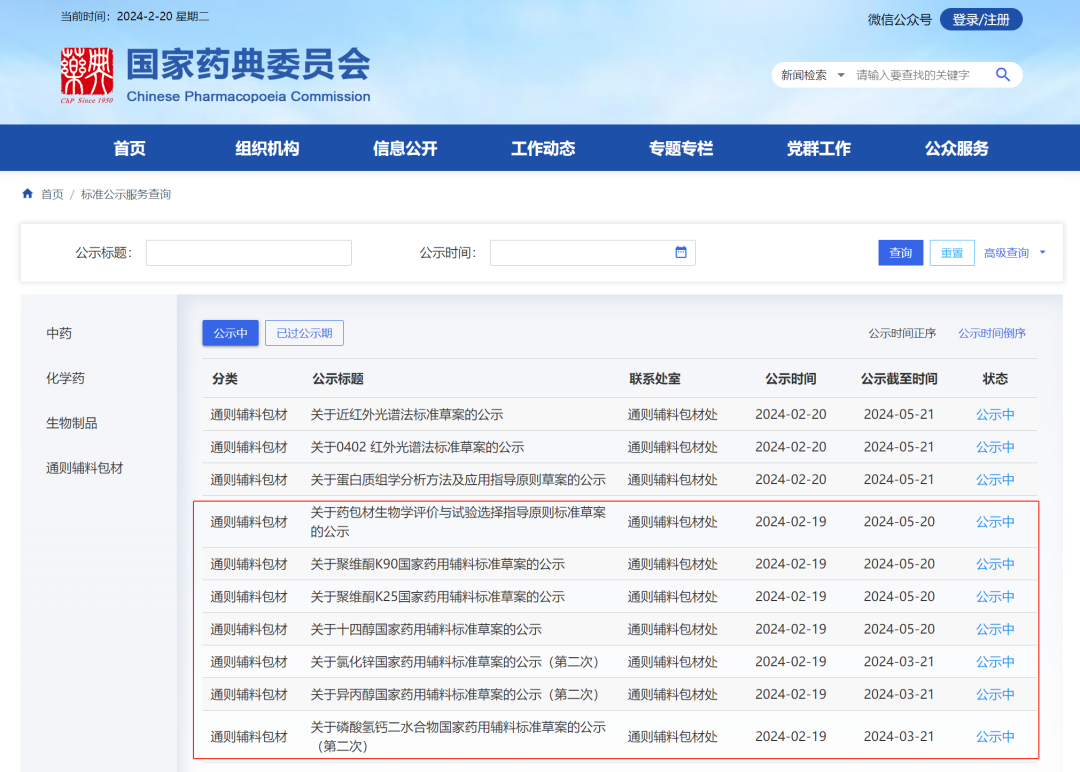
2024年2月19日,国家药典委员会公示聚维酮K90、聚维酮K25、氯化锌、大豆油(供注射用)、阿拉伯胶等11个国家药用辅料标准草案。其中3个标准草案为首次公示,另8个标准草案为第二次公示。11个草案对起草进行了说明。
起草说明:
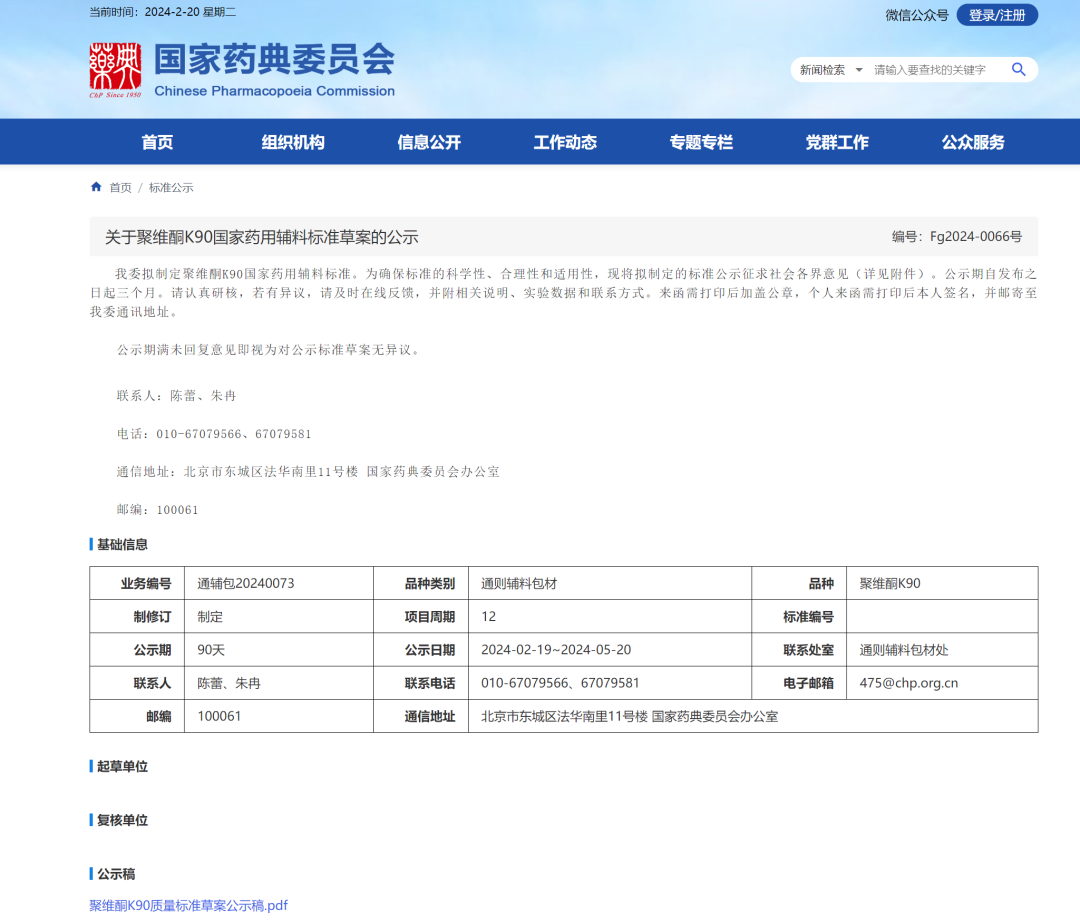
1、聚维酮K90国家药用辅料标准草案
一、 定义参考中国药典 2020 年版四部聚维酮 K30,但未对平均分子量进行描述。
二、 性状 根据收集到的不同生产企业样品的实际性状进行拟定,并与系列品种协调一致。
三、 鉴别 参照中国药典 2020 年版四部聚维酮 K30,其中红外鉴别改为与对照图谱一致。
四、 检查
1. 酸度 参考中国药典 2020 年版四部聚维酮 K30,依照中国药典 0631“pH 值测定法”操作。
2. 溶液的澄清度与颜色 参考中国药典 2020 年版四部聚维酮 K30,依照中国药典 0901 第一法“溶液颜色测定法” 及 0902“澄清度检查法”操作。
3. K 值 参考中国药典 2020 年版四部聚维酮 K30,根据实际测定结果,再参考 EP,确定 K 值限度 值为 81.0~97.2。
4. 醛 参考中国药典 2020 年版四部聚维酮 K30,以乙醛计,不得过 0.05%。
5.N-乙烯基吡咯烷酮 参考中国药典 2020 年版四部聚维酮 K30,限度值为不得过 0.001%。
6.2-吡咯烷酮 参考中国药典 2020 年版四部聚维酮 K30,根据实际测定结果,限度值为不得过 2.0%。
7.甲酸 参考 EP 聚维酮的方法,选择强酸性离子交换柱,限度值为 0.5%。
8.过氧化物 参考中国药典 2020 年版四部聚维酮 K30,限度为不得过 0.35(相当于 0.04%的 H2O2)。
9.肼 参考中国药典 2020 年版四部聚维酮 K30,限度为不得过 0.0001%。
10.水分 参考中国药典 2020 年版四部聚维酮 K30,依照中国药典 0832“水分测定法”操作。
11.炽灼残渣 参考中国药典 2020 年版四部聚维酮 K30,依照中国药典 0841“炽灼残渣检查法”操作。
12.含氮量 参考中国药典 2020 年版四部聚维酮 K30,依照中国药典 0704“氮测定法”操作。
五、 类别 按聚维酮 K90 作为药用辅料的主要功能制定。
六、 注 根据中国药典药用辅料与 ICH Q3D 协调方案,采用所建立的方法对收集到的样品进行检测与评估,部分厂家样品钒超过注射用推荐控制阈值,故以“注”的形式给出钒元素的控制要求。
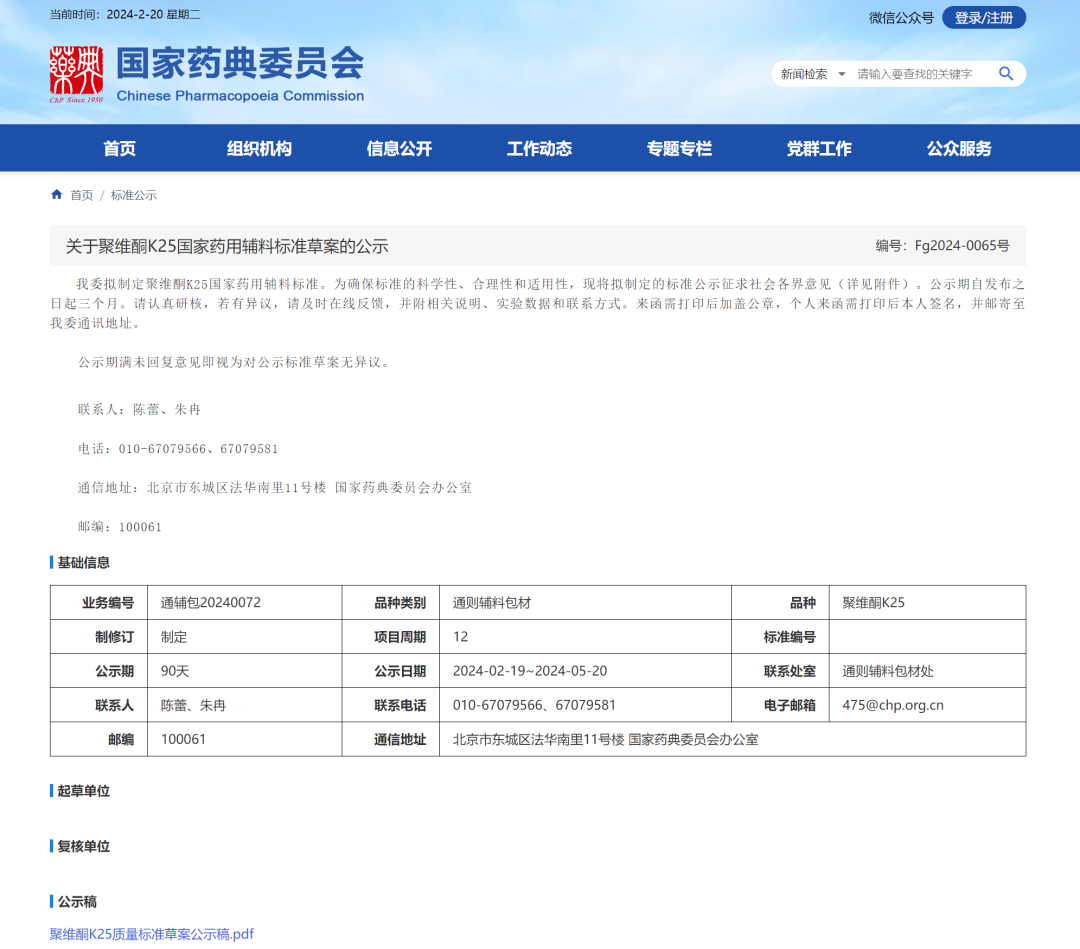
2、聚维酮K25国家药用辅料标准草案
一、 定义 参考中国药典 2020 年版四部聚维酮 K30,但未对平均分子量进行描述。
二、 性状 根据收集到的不同生产企业样品的实际性状进行拟定,并与系列品种协调一致。
三、 鉴别 参照中国药典 2020 年版四部聚维酮 K30,其中红外鉴别改为与对照图谱一致。
四、 检查
1. 酸度 参考中国药典 2020 年版四部聚维酮 K30,依照中国药典 0631“pH 值测定法”操作。
2. 溶液的澄清度与颜色 参考中国药典 2020 年版四部聚维酮 K30,依照中国药典 0901 第一法“溶液颜色测定法” 及 0902“澄清度检查法”操作。
3. K 值 参考中国药典 2020 年版四部聚维酮 K30,根据实际测定结果,同时参考 EP,确定 K 值限度 值为 22.5~27.0。
4. 醛 参考中国药典 2020 年版四部聚维酮 K30,以乙醛计,不得过 0.05%。
5.N-乙烯基吡咯烷酮 参考中国药典 2020 年版四部聚维酮 K30,限度值为不得过 0.001%。
6.2-吡咯烷酮 参考中国药典 2020 年版四部聚维酮 K30,根据实际测定结果,现行版欧美药典同品种标准 中该检查项的限值均为 3.0%,现设定限度值为不得过 3.0%。
7.甲酸 参考 EP 聚维酮的方法,选择强酸性离子交换柱,限度值为 0.5%。
8.过氧化物 参考中国药典 2020 年版四部聚维酮 K30,限度为不得过 0.35(相当于 0.04%的 H2O2)。
9.肼 参考中国药典 2020 年版四部聚维酮 K30,限度为不得过 0.0001%。
10.水分 参考中国药典 2020 年版四部聚维酮 K30,依照中国药典 0832“水分测定法”操作。
11.炽灼残渣 参考中国药典 2020 年版四部聚维酮 K30,依照中国药典 0841“炽灼残渣检查法”操作。
12.含氮量 参考中国药典 2020 年版四部聚维酮 K30,依照中国药典 0704“氮测定法”操作。
五、 类别 按聚维酮 K25 作为药用辅料的主要功能制定。
六、 注 根据中国药典药用辅料与 ICH Q3D 协调方案,采用所建立的方法对收集到的样品进行检测与评估,部分厂家样品钒超过注射用推荐控制阈值,故以“注”的形式给出钒元素的控制要求。
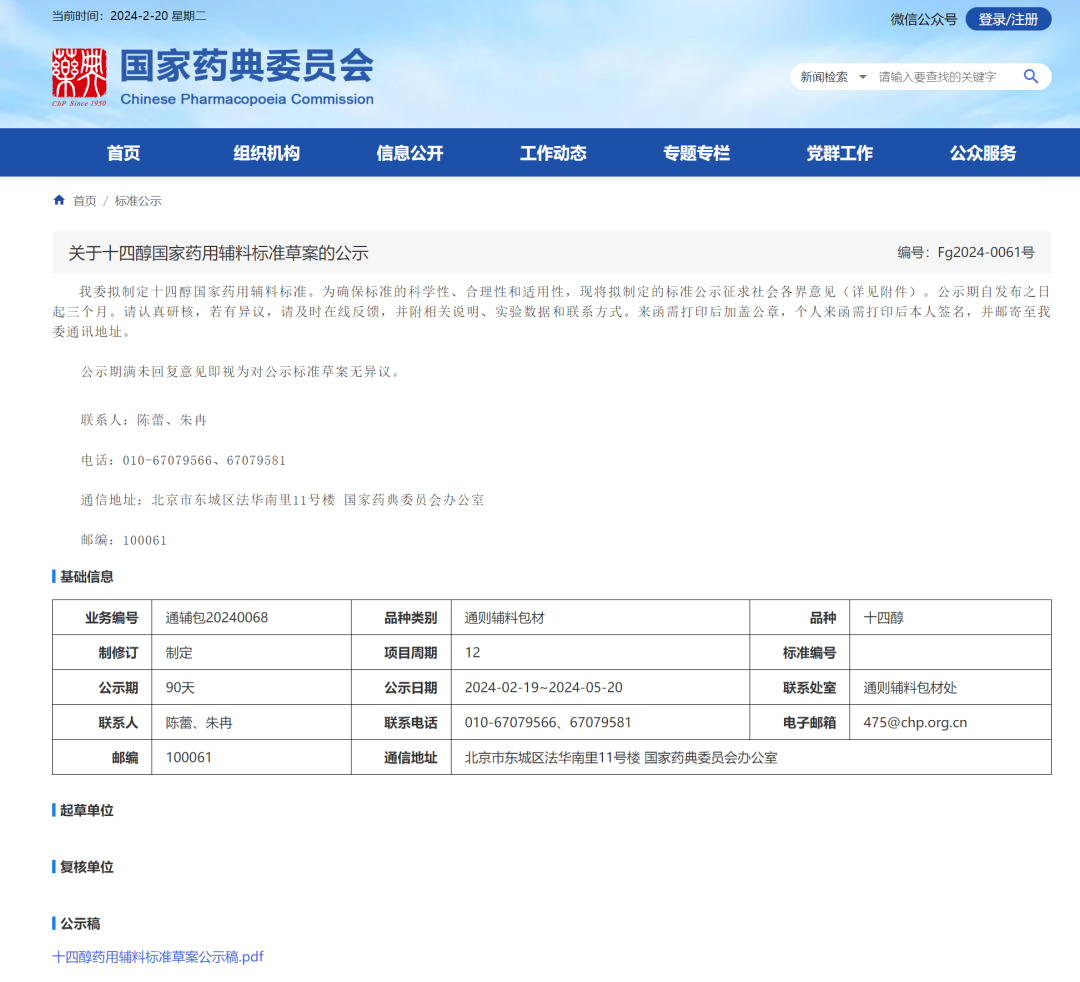
3、十四醇国家药用辅料标准草案
一、 名称与含量限度
1.名称 参照中国药典同系列品种,将本品名称修订为“十四醇”。本品别名肉豆蔻醇。
2.来源及含量限度 参照 USP 现行版制订,但比 USP 现行版增加了“按无水物计算”。
二、 修订性状项
1、熔点 USP 现行版已删除本项目,故本次删除熔点项目。
2、酸值 、碘值 参照中国药典同系列品种 ,限度分别严格至 2.0 和 1.0。
3、羟值 参考 USP 现行版对测定方法进行修订,限度不变。
4.皂化值 参考中国药典 2020 年版中同系列产品十六醇、十六十八醇和十八醇标准增订本项目,方法 采用通则 0713 中皂化值方法。
三、 增修订检查项
1、碱度 参考中国药典 2020 年版中同系列产品十六醇、十六十八醇和十八醇标准增订本项目,方法 限度一致。
2、乙醇溶液的澄清度与颜色 参考中国药典 2020 年版中同系列产品十六醇、十六十八醇和十八醇标准增订本项目,方法 限度一致。
3、有关物质 参照 USP 现行版以及中国药典 2020 年版中同系列产品十六醇、十六十八醇和十八醇标准 修订本项目,并结合实际试验情况拟订色谱条件和系统适用性要求。
4、炽灼残渣 参照 USP 现行版增订,方法照 2020 年版中国药典四部通则 0841,限度为“不得过 0.1%”。
四、 含量测定项 参照 USP 现行版修订,计算方法由公示稿的“以面积归一化法计算”改为“以内标法计算”, 限度由公示稿的“不得少于 90.0%”修订为“以无水物计,含 C14H30O 应为 90.0%~102.0%”, 并结合实际试验情况拟订色谱条件和系统适用性要求。
五、 类别 参考《药用辅料手册》中的描述“emollient,emulsion stabilizer,oleaginous vehicle,surfacant, thickening agent,viscosity-controlling agent”修订为“柔软剂和稳定剂”。
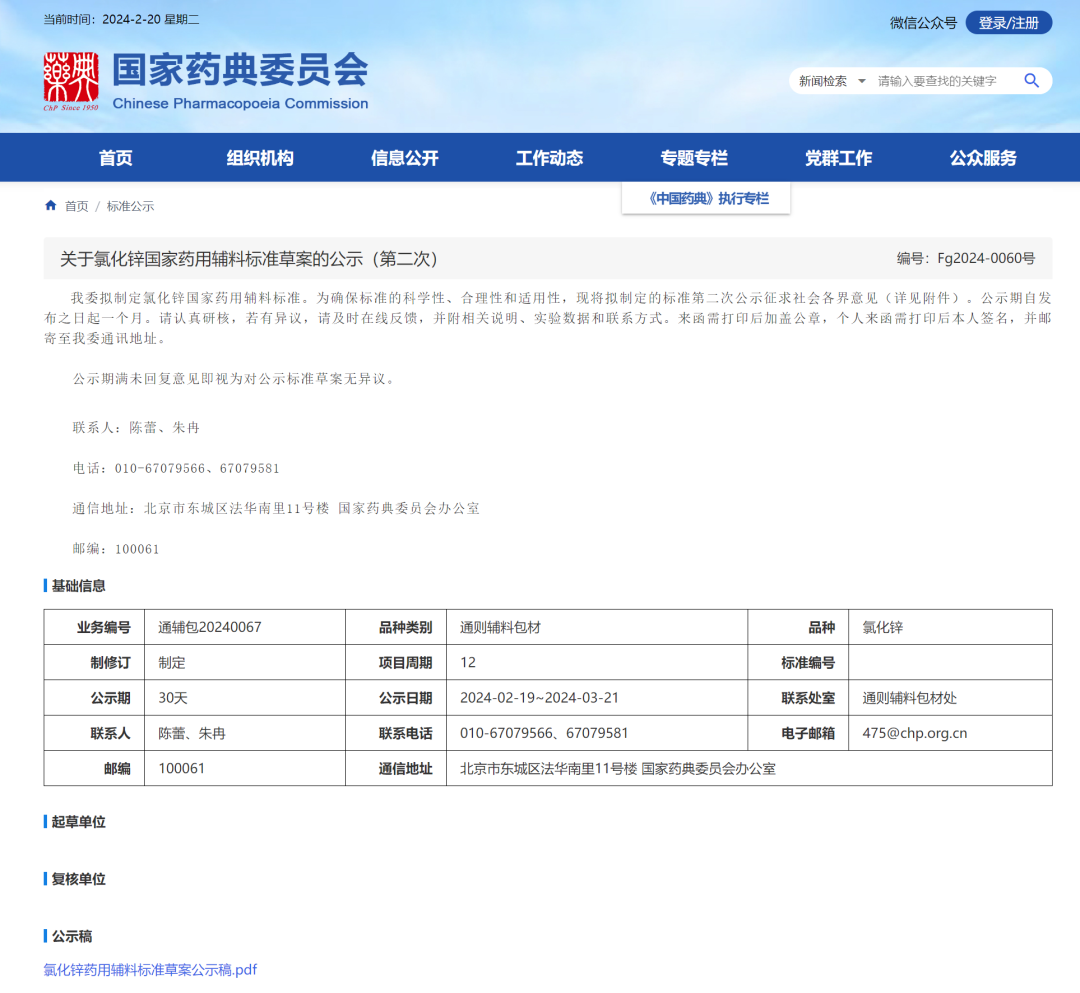
4、 氯化锌国家药用辅料标准草案(第二次)
一、硫酸盐 工业锌灰作为氯化锌、氧化锌等化合物的物料来源,其中主要成分是锌,还含有少量铁、 铜的硫酸盐。各国药典均控制硫酸盐,标准草案的限度参考 USP。
二、镉、铅 氯化锌的初始原料为锌矿,锌矿有闪锌矿、菱锌矿、红锌矿、硅锌矿等。闪锌矿分布最 广,常含镉、铅等元素。铅和镉均为 1 类元素,存在一定的安全风险。根据元素杂质评估情况,铅在标准正文中单独设置检查项;镉元素未在中文中收载该项目,但在“注”项下提示相关企业,必要时可考虑控制本品中的镉。
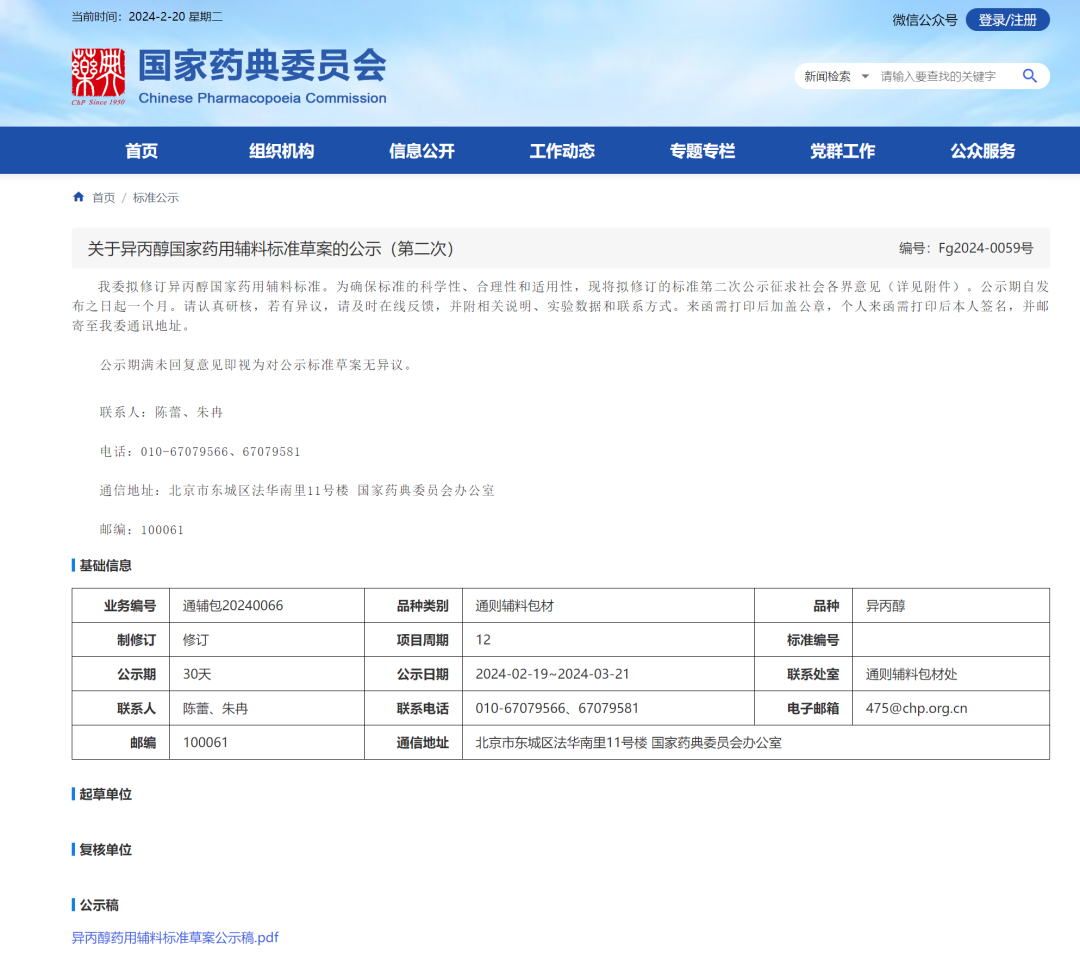
5、异丙醇国家药用辅料标准草案(第二次)
1、吸光度:明确以水为空白。
2、挥发性杂质:基于第一次公示稿文字修订。
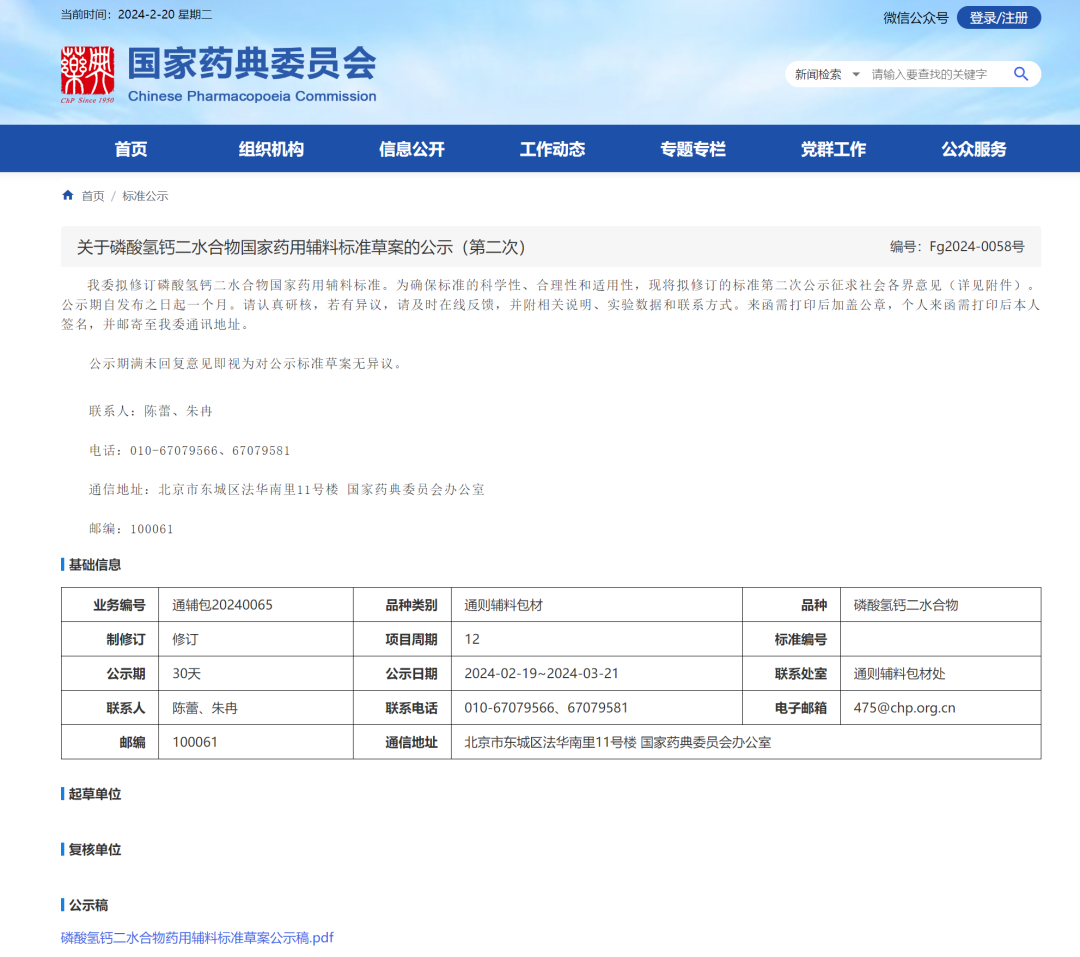
6、磷酸氢钙二水合物国家药用辅料标准草案(第二次)
氟化物 该项目下氟元素含量计算公式中的稀释倍数应为 250。
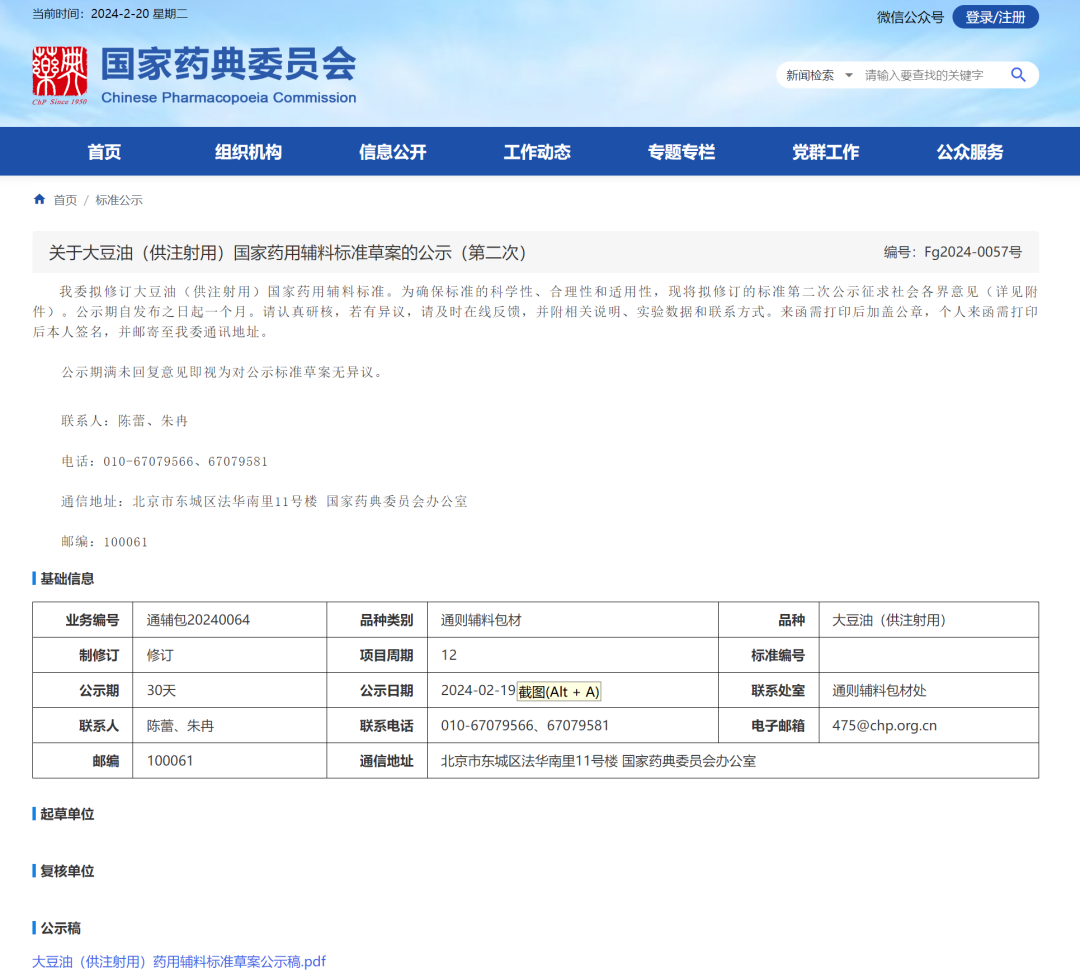
7、大豆油(供注射用)国家药用辅料标准草案(第二次)
一、删除检查项
1、棉籽油:本项目仅 ChP2020 收载,国家标准和其他各国药典均未收载。为配合药典会《关于推进“绿色环保”药用辅料标准第一批重点项目的通知》要求,避免使用危化品二硫化碳,同时考虑到本品种已有脂肪酸组成、甾醇组成等精密仪器方法进行控制,故删除此项目。
2、重金属与砷盐:根据中国药典与ICH O3D指导原则的协调方案,对结合样品实际测定结果,大豆油(供注射用)存在1类、2类和3类元素的风险较低,故删除重金属和砷盐项目。
二、修订检查项
1、溶解度:为配合药典委《关于推进“绿色环保”药用辅料标准第一批重点项目的通知》要求,避免使用有毒试剂三氯甲烷,故删除在三氯甲烷中的溶解度。
2、脂肪酸组成:本项目除IPXⅦ外各国药典均有收载,本次标准参考中国药典二部大豆油(供注射用)的公示稿将色谱柱描述修订为“2-硝基对苯二酸改性的聚乙二醇(FFAP)为固定液的毛细管柱为色谱柱(30mx0.25mm,0.25um 或效能相当的色谱柱)”
3、细菌内毒素:对大豆油(供注射用)标准中细菌内毒素项目内容进行了规范。
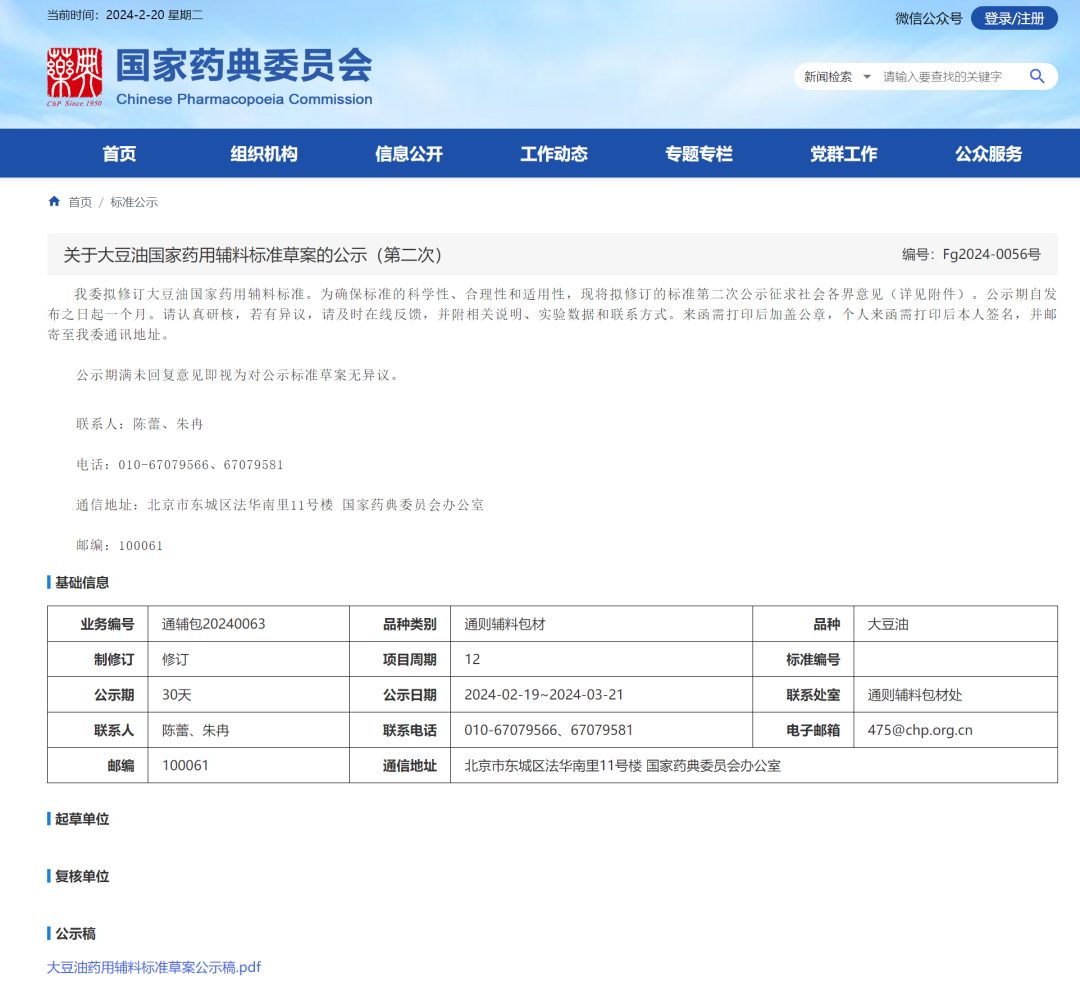
8、大豆油国家药用辅料标准草案(第二次)
一、 删除检查项
1、棉籽油 本项目仅 ChP2020 收载,国家标准和其他各国药典均未收载。为配合药典会《关于推进“绿 色环保”药用辅料标准第一批重点项目的通知》要求,避免使用危化品二硫化碳,同时考虑到 本品种已有脂肪酸组成、甾醇组成等精密仪器方法进行控制,故删除此项目。
2、重金属与砷盐 根据中国药典与 ICH Q3D 指导原则的协调方案,结合样品实际测定结果,大豆油存在 1 类、 2 类和 3 类元素的风险较低,故删除重金属和砷盐项目。
二、 修订检查项
1、溶解度 为配合药典委《关于推进“绿色环保”药用辅料标准第一批重点项目的通知》要求,避免 使用有毒试剂三氯甲烷,故删除在三氯甲烷中的溶解度。
2、脂肪酸组成 本项目参考中国药典二部大豆油(供注射用)的公示稿将色谱柱描述修订为“2-硝基对苯 二酸改性的聚乙二醇。
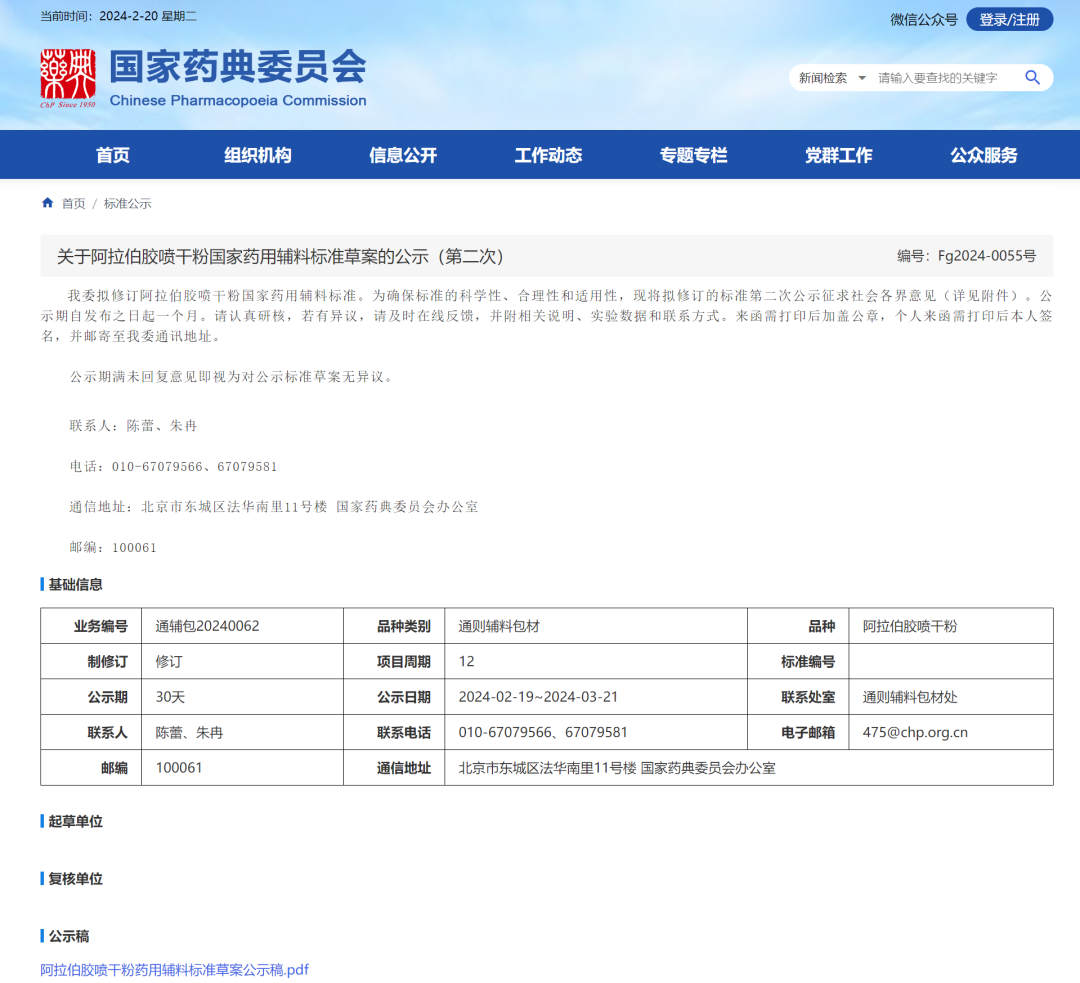
9、阿拉伯胶喷干粉国家药用辅料标准草案(第二次)
一、 删除【检查】重金属
根据 ICHQ3D 原则进行元素杂质考察,结合 ICP-MS 方法对 1 类元素和 2A 类元素的考察评估结果,删除重金属检查项.
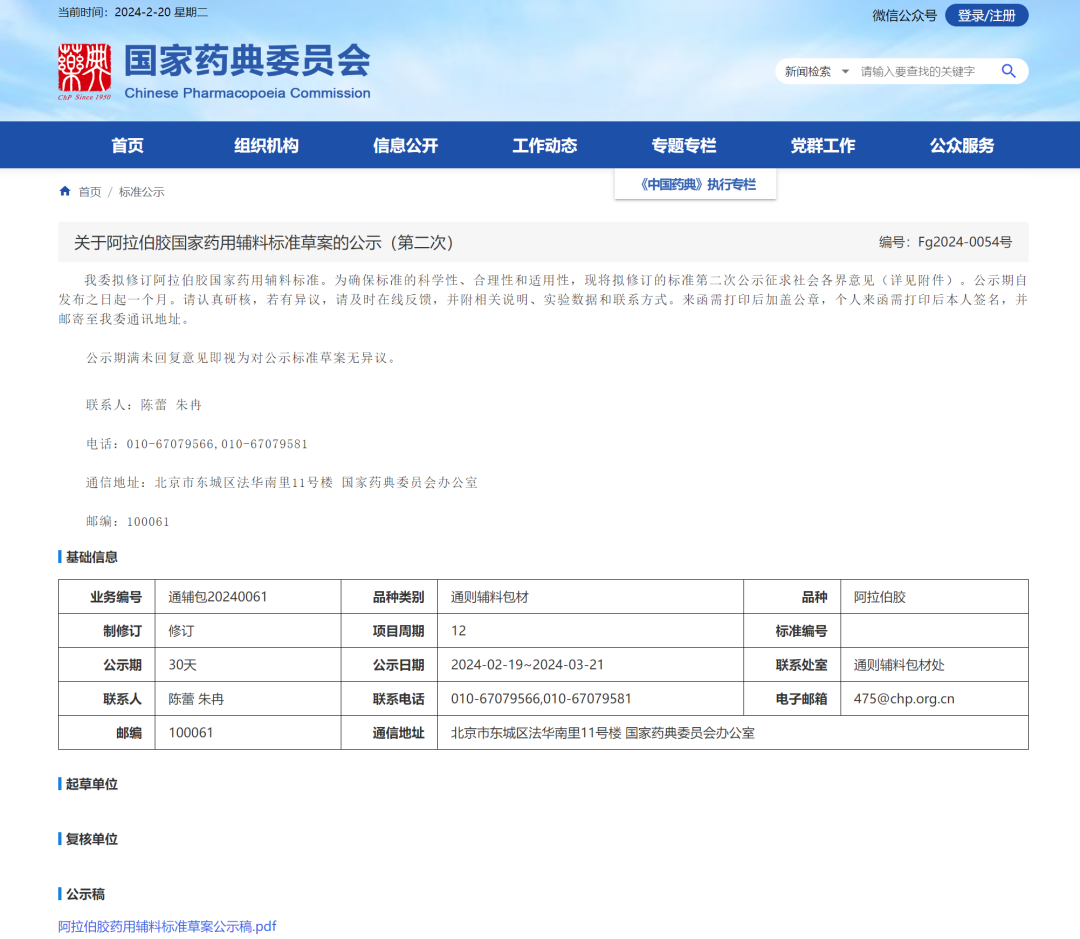
10、阿拉伯胶国家药用辅料标准草案(第二次)
一、删除【检查】重金属
根据 ICHO3D 原则进行元素杂质考察,结合ICP-MS 方法对1类元素和 2A类元素的考察评估结果,删除重金属检查项。
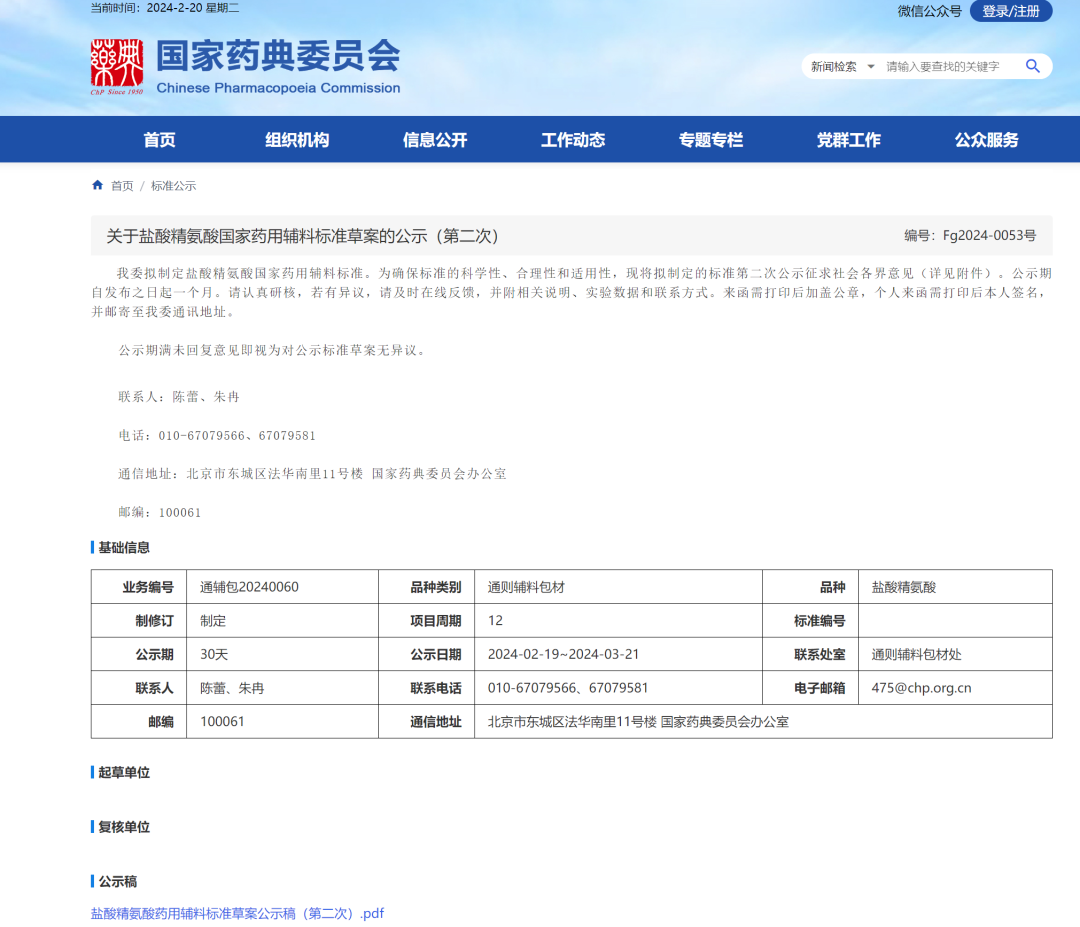
11、盐酸精氨酸国家药用辅料标准草案(第二次)
1.对【检查】项目“其他氨基酸”进行文字修改和规范。
2.根据 ICH Q3D 原则进行元素杂质考察,结合 ICP-OES 方法对 1 类元素、 2A 类元素和 3 类元素以及铁(Fe)元素的考察评估结果,删除重金属检查项、砷盐检查项和铁盐检查项。
标签:
【免责声明】
1.“高鹏说药材”致力于提供中药行业各类资讯信息,但不保证信息的合理性、准确性和完整性,且不对因信息的不合理、不准确或遗漏导致的任何损失或损害承担责任。
2.“高鹏说药材”部分文章信息来源于网络转载是出于传递更多信息之目的,并不意味着赞同其观点或证实其内容的真实性。如对内容有疑议,请及时与我平台联系。
3.“高鹏说药材”所有信息仅供参考,不做任何商业交易及或医疗服务的根据,如自行使用“高鹏说药材”内容发生偏差,我平台不承担任何责任,包括但不限于法律责任,赔偿责任。
4.“高鹏说药材”各类带“原创”标识的资讯,享有著作权及相关知识产权,未经本网站协议授权,任何媒体、网站、个人不得转载、链接或其他方式进行发布;经本网协议授权的转载或引用,必须注明“来源:高鹏说药材(www.gpsyc.com)”。违者本网站将依法追究法律责任。
5.本声明未涉及的问题参见国家有关法律法规,当本声明与国家法律法规冲突时,以国家法律法规为准。
最新文章

药材行业烂摊子怎么破?这位老党员砸了铁饭碗,搞了三个“猛项目
朋友们,做药材的、搞健康产业的,最近是不是感觉特别难?药材价...(915 )人阅读时间:2025-09-25
坦白讲!中医养生这么火,但不懂行千万别瞎搞!
朋友,你是不是也瞅着中医养生这波热潮,心里痒痒的?但一想到水...(563 )人阅读时间:2025-09-25
高久恒说药材寻创业合伙人:一起把老祖宗的好东西,变成这个时代
一、平台简介:高久恒说药材——您身边的中医药创业引路人在健康...(768 )人阅读时间:2025-09-25
高久恒说药材寻创业合伙人:一起把老祖宗的好东西,变成这个时代
一、平台简介:高久恒说药材——您身边的中医药创业引路人在健康...(704 )人阅读时间:2025-09-24


 转自:国家市场监管局 综合:青于蓝5月28日,国家市场监管总...
转自:国家市场监管局 综合:青于蓝5月28日,国家市场监管总... 转自:上海阳光医药采购网 编辑:水晶3月29日,上海阳光医药...
转自:上海阳光医药采购网 编辑:水晶3月29日,上海阳光医药... 来源:国家药监局 编辑:wangxinglai200...
来源:国家药监局 编辑:wangxinglai200... 关于发布《保健食品原料目录 营养素补充剂(2023年版)》《...
关于发布《保健食品原料目录 营养素补充剂(2023年版)》《...




