医药反腐时代,中成药如何发展?
时间:2023-10-06人气:作者: 赛柏蓝
近月来,医疗反腐正轰轰烈烈地进行中,很多药企又重新审视其自身战略选择问题——用什么驱动产品发展?
是变革,就会有阵痛。随着反腐常态化、改革深入化,传统营销方式将越来越被动。
价值营销如何做?营销如何驱动?品牌如何驱动?产品如何驱动?除做好产品矩阵规划引进新品外,就单产品的价值营销如何驱动业绩健康增长?
笔者认为链路应该是评价产品市场价值→价值定位(STP)→医学驱动准入/驱动价值(产品)→市场驱动品牌认知→销售/推广价值转化。
其中各环节信息流需要贯通,即需要建立价值反馈的信息模型,各个模块既相互独立,又互相辩证求真去伪。
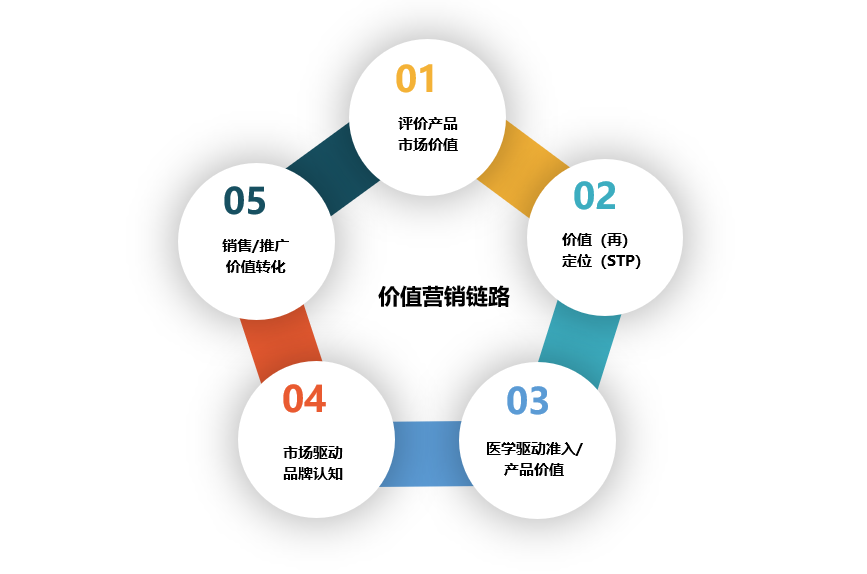
本文只就医学驱动深入阐述,明确价值营销下药企医学部(中成药偏上市后)如何发挥真正效能,让好的产品真正发挥价值。
01
与医学驱动相关的政策梳理
宏观政策梳理,可以帮助企业建立整体政策框架的洞察力。
(一)《国务院办公厅关于印发中医药振兴发展重大工程实施方案的通知》/国务院办公室——“十四五”中医药发展规划
1、中医药传承创新和现代化工程:布局一批中医药科技创新重点项目和关键技术装备项目,加强中医药科技创新体系建设,提升传承创新能力,加快推进中医药现代化。
2、中医药科技创新平台建设:完善以国家中医药传承创新基础研究、临床研究、科技创新平台为主要支撑的中医药科技创新体系;建设若干中医药相关多学科交叉融合的全国重点实验室、中医类国家临床医学研究中心和30个左右国家中医药传承创新中心、100个左右国家中医药局重点实验室;配套措施:在省级科研项目中加大对中医药科技创新平台的支持力度。
3、中医药科技重点项目研究:布局一批中医药科研项目;筛选50个中医优势病种。
4、做大做强中医科学院:中国中医药循证医学中心。
(二)《2023国家基本医疗保险、工伤保险和生育保险药品目录调整工作方案》
1、医保准入涉及有效性、安全性、经济性、创新性、公平性综合评价;强调与参照药品或已上市的同治疗领域药品对比;大致可理解为安全性是基础,重点关注与目录内同治疗领域药品的安全性方面的主要优势和不足。
2、经济性评价的核心,结合优效性(与对照药品——重点关注目录内同治疗领域药品,疗效相比较该药品的主要优势和不足)及医保基金承受的综合测算限价。
(三)2022年底发布的《中药保护品种条例(修订草案征求意见稿)》
1、中药保护品种可在一定时期内独占市场,且有利于基药准入→持续创新提升独家产品的循证证据;
2、首家增加功能主治的中成药给予一定年限独家保护→可延长独占市场的年限,避免被同名同方,导致迅速丢失市场。
(四)《关于印发深化医药卫生体制改革2023年下半年重点工作任务的通知》
1、持续推进基本药物优先配备使用;开展药品临床综合评价。
2、《药品临床综合评价管理指南》主要用于国家和省级卫生健康部门基于遴选疾病防治基本用药、拟定重大疾病防治基本用药政策、加强药品供应管理等决策目的。《药品临床综合评价管理指南》和《中成药临床综合评价指南》相关内容不做赘述。
小结:
1、医学准入完全符合以患者为中心的价值营销理念;
2、各个准入政策之间对于循证证据支持的要求基本一致;
3、医学驱动已是大势所趋,没有治疗价值(或弱)或者治疗价值未被挖掘的产品会被市场淘汰/边缘化(准入淘汰或者诊疗淘汰);
4、医学事务应保持“初心”,通过政策研究,产品洞察,持续挖掘其与当前最优治疗决策对照的差异化治疗价值(人无我有、人有我优)。
02 医学驱动下的产品生命周期管理
(一)医学研究的合作主体怎么选?
1、中成药综合评价依托的主体单位是中医科学院,学会则是中华中医药学会。
2、其他相关主体单位主要为自己产品归属治疗领域的中医类国家临床医学研究中心和30个左右国家中医药传承创新中心、100个左右国家中医药局重点实验室。
3、上述机构内的研究者则是医学研究部门需要重点沟通及合作的,可以更好理解国家中医药发展的政策及技术要求,便于更好的制定医学研究策略及研究项目组合。
(二)什么产品(上市后)具备医学研究投入的条件?
1、独家和部分剂型独家;
2、临床价值挖掘后明确具备潜在或已被实践验证的差异化优势的;
3、产品准入(指南、医保、中保、基药等,尤其是医保)具备可准入路径及条件的;
上述三条评价基本可评价产品差异化优势(区隔竞品、可市场准入)。
(三)如何做好医学规划的顶层设计?
1、医学研究本质上是在验证医学假设和证实真实诊疗获益的事实,但前提是必须为差异化优势,否则就不具备研究投入的价值,在驱动准入及市场营销中不会助力竞争优势。
2、以产品差异化优势(含潜在的尚未被挖掘的)为中心,建立医学研究的顶层规划,充分论证其未来的市场价值及准入机会,而后逐步推进。
3、顶层规划的论证需要充分参考产品其治疗领域内国家认可的权威机构及权威专家的意见,形式上可采用一对一专家咨询及咨询会形式。一旦顶层规划确定,则不动摇不偏移的在战术上执行好,同时做好阶段性复盘,避免体系性决策失误。
这个看起来矛盾,实则不然,顶层规划时不留任何盲点,不急于一时,不盲目而动,做到真正夯实确证,需要在做顶层规划时即设计一套论证的方法模型;在战术上做好阶段性复盘更多的是纠偏,同时保持自我否定的觉悟认知,避免策略决策错误。
4、保持营销体系的同频共振,尤其是市场部。
医学和市场在营销体系均属于策略部门,两个部门共同的链接点是价值挖掘而来的价值定位(STP),只是医学的前瞻价值更高,除做好现有优势提高证据级别外,还具备挖掘潜在价值的意义。
医学规划及项目立项均需要邀请市场部门参与,便于保证医学策略与市场策略不割裂,保持同频实现共振。
加强营销体系培训,除做好医学支持外,重点应向医学洞察的阶段性成果及医学顶层规划认知培训,提高支持度。同时营销各部门与医学直接及间接相关的板块积极参与,保持高度同频,实现融合共进。
5、充分认知医学准入时代的到来。
前文政策梳理不难发现,随着三医联动医改的逐步深入,国家对于药品价值评价体系的日趋成熟,价值挖掘越来越会更加规范公平的驱动产品准入及市场准入,一旦在产品准入上出现问题,真正有价值的产品无法借助政策支持获益,既往建立的品牌支持容易因为产品准入短板被无限放大,存量也会蒙受巨大的影响。
6、中成药上市后产品价值挖掘的特殊性。
一方面中成药往往具有多个适应症,异病同治;推广驱动历史沿袭,医生会有固有认知,在做访谈咨询时信息的确定性偏差;上市后研究缺乏顶层设计,不具备可靠的循证支持等因素会限制、误导价值挖掘的决策。
另一方面,中成药因异病同治,多组份,给治疗价值挖掘又带来了很多可能性,大大提升了上市后医学研究的必要性,拓展治疗领域,延长产品生命周期比化药更具备先天优势。
医学驱动中成药产品生命周期管理是个系统性的理论+实践体系,本文仅仅谈到了偏策略的内容,且更适用于处方药身份的中成药,还需要大家广泛研究,持续保持交流。
标签:
【免责声明】
1.“高鹏说药材”致力于提供中药行业各类资讯信息,但不保证信息的合理性、准确性和完整性,且不对因信息的不合理、不准确或遗漏导致的任何损失或损害承担责任。
2.“高鹏说药材”部分文章信息来源于网络转载是出于传递更多信息之目的,并不意味着赞同其观点或证实其内容的真实性。如对内容有疑议,请及时与我平台联系。
3.“高鹏说药材”所有信息仅供参考,不做任何商业交易及或医疗服务的根据,如自行使用“高鹏说药材”内容发生偏差,我平台不承担任何责任,包括但不限于法律责任,赔偿责任。
4.“高鹏说药材”各类带“原创”标识的资讯,享有著作权及相关知识产权,未经本网站协议授权,任何媒体、网站、个人不得转载、链接或其他方式进行发布;经本网协议授权的转载或引用,必须注明“来源:高鹏说药材(www.gpsyc.com)”。违者本网站将依法追究法律责任。
5.本声明未涉及的问题参见国家有关法律法规,当本声明与国家法律法规冲突时,以国家法律法规为准。
最新文章

药材行业烂摊子怎么破?这位老党员砸了铁饭碗,搞了三个“猛项目
朋友们,做药材的、搞健康产业的,最近是不是感觉特别难?药材价...(915 )人阅读时间:2025-09-25
坦白讲!中医养生这么火,但不懂行千万别瞎搞!
朋友,你是不是也瞅着中医养生这波热潮,心里痒痒的?但一想到水...(563 )人阅读时间:2025-09-25
高久恒说药材寻创业合伙人:一起把老祖宗的好东西,变成这个时代
一、平台简介:高久恒说药材——您身边的中医药创业引路人在健康...(768 )人阅读时间:2025-09-25
高久恒说药材寻创业合伙人:一起把老祖宗的好东西,变成这个时代
一、平台简介:高久恒说药材——您身边的中医药创业引路人在健康...(704 )人阅读时间:2025-09-24


 日前,三明采购联盟省际中药(材)采购联盟采购办公室公示中药饮...
日前,三明采购联盟省际中药(材)采购联盟采购办公室公示中药饮... 为进一步提高参保人员用药保障水平,规范医保用药管理,建立管...
为进一步提高参保人员用药保障水平,规范医保用药管理,建立管... 6月21日,全国中成药首次集采将在武汉正式开标,百亿中药市场...
6月21日,全国中成药首次集采将在武汉正式开标,百亿中药市场... 6月9日,2023年医保目录调整方案发布征求意见稿,这意味着...
6月9日,2023年医保目录调整方案发布征求意见稿,这意味着...




