巨变在即!多款明星药专利明年到期,事涉阿斯利康、诺华等
时间:2023-10-02人气:作者: 新康界
随着2024年众多药物核心化合物专利的临近到期,市场竞争预计将变得愈发激烈,进而催生新的市场格局与发展机遇。本文将重点关注其中几种在治疗多种疾病方面表现出色的药物,包括阿斯利康研发的奥拉帕利、诺华的西尼莫德、阿斯利康与Ironwood合作推出的利那洛肽,以及亿腾医药与盐野义制药合作的芦曲泊帕
奥拉帕利是FDA批准的首个口服多聚ADP核糖聚合酶(PARP)抑制剂,其原理是通过使用PARP抑制剂来杀死DNA修复缺陷型癌细胞,特别是BRCA1/2突变型癌细胞。这一药物由阿斯利康开发,于2014年12月分别在欧盟和美国获得批准上市,并于2018年8月在国内获得批准上市,成为国内首个上市的PARP抑制剂。奥拉帕利已被批准用于治疗卵巢癌、乳腺癌、去势抵抗性前列腺癌、胰腺癌、输卵管癌、腹膜癌等多种适应症。在国内市场上,目前有五种PARP抑制剂,包括阿斯利康的奥拉帕利、百济神州的帕米帕利、GSK与再鼎医药联合开发的尼拉帕利、恒瑞医药的氟唑帕利以及辉瑞的他拉唑帕利。表1. 2022-2023H1年国内获批PARP抑制剂的销售额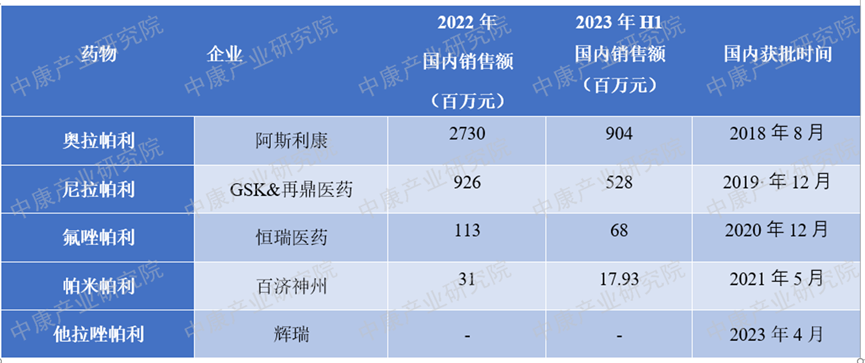
如表1所示,奥拉帕利在国内PARP抑制剂市场处于市场领先地位,销售额远超排在第2位的尼拉帕利。如图1所示,奥拉帕利在2022年等级医院市场销售额达到13亿元。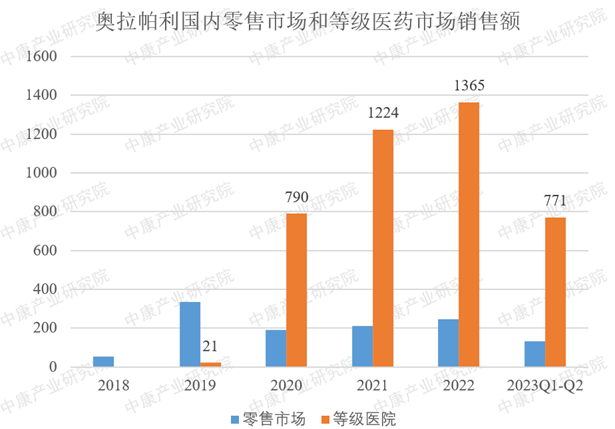
在全球市场方面,奥拉帕利的销售额同样表现出色,达到了26.38亿美元,如图2所示。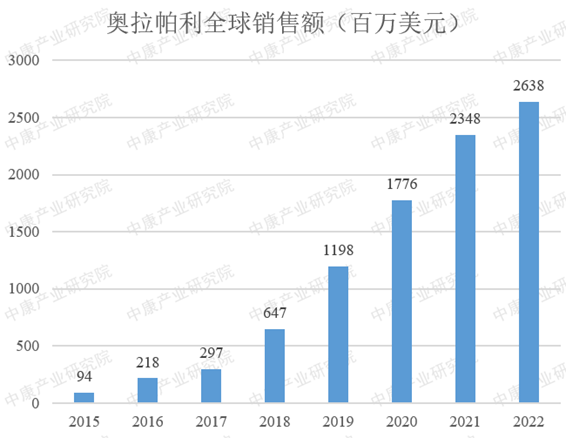
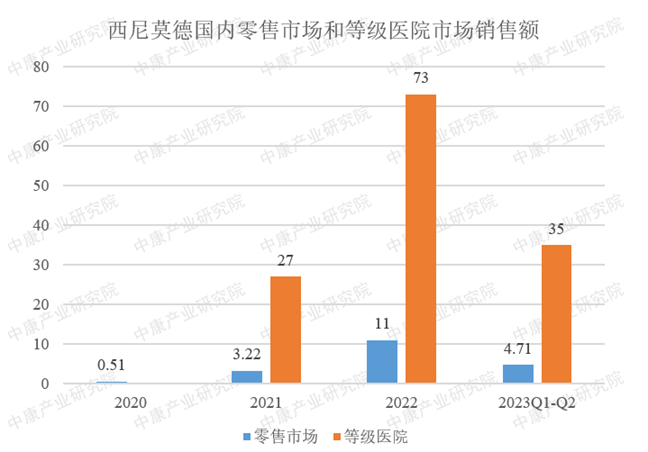
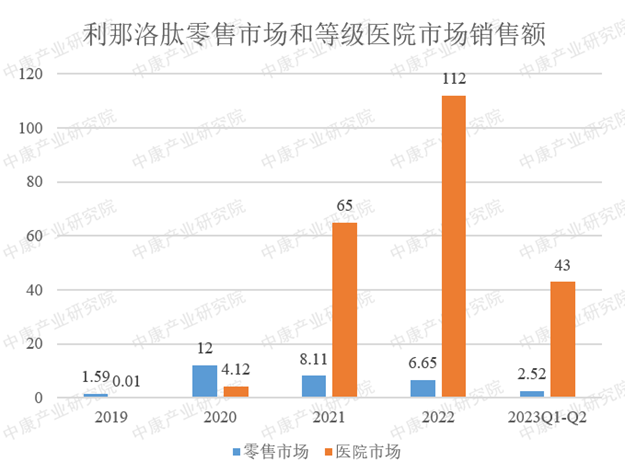
奥拉帕利的核心化合物专利(ZL200480012878.1)将于2024年3月12日到期。目前,国内已有湖南科伦制药、齐鲁制药、石药欧意、中美华东制药、山香药业、方生和医药/利泰尔药业、上海宣泰医药/江苏宣泰药业等9家药企提交了奥拉帕利片的仿制上市申请,其中齐鲁制药率先获批,成为国内首家获批的仿制药企。待奥拉帕利核心专利到期后,国内PARP抑制剂市场竞争将进入白热化。西尼莫德片(商品名:万立能)在2020年5月通过NMPA的优先审批程序获批上市,用于治疗成人复发型多发性硬化,包括临床孤立综合征、复发-缓解型疾病和活动性继发进展型疾病。它最早在2019年3月获得美国FDA的批准上市。这是自15年来FDA首次批准用于治疗复发缓解型多发性硬化(RRMS)的药物。多发性硬化(MS)是一种慢性炎症性自身免疫疾病,患者的自身免疫系统攻击保护神经的髓鞘,导致神经功能的损伤,大多数患者在20-40岁之间出现首次症状,是造成青壮年神经功能残疾最常见原因之一。MS分为三种主要临床病程:原发进展型多发性硬化(PPMS)、复发缓解型多发性硬化(RRMS)、继发进展型多发性硬化(SPMS)。自2020年获批以来,西尼莫德在国内市场呈现迅猛增长的势态,在2022年整体市场销量达到8400万。不过,值得关注的是,西尼莫德核心化合物专利(ZL200480013248.6)即将于2024年5月19日到期。目前,国内布局西尼莫德仿制药的企业较为有限,科伦药业是首家递交西尼莫德片仿制药上市申请的企业,并有望斩获西尼莫德首仿。利那洛肽,由Ironwood自主研发,是一种激动鸟苷酸环化酶-C(GC-C)的创新药物,得到美国消化病学会(AGA)指南的认可,被推荐用于治疗便秘型肠易激综合征(IBS-C),也被视为治疗这种疾病的标准药物。阿斯利康与Ironwood合作,获得了在中国(除台湾外)独家开发、生产和商业化的权利。肠易激综合征(IBS)是一种常见的功能性肠病,其中IBS-C是其一种亚型,其主要临床症状包括反复发作的便秘以及伴随排便的腹痛、腹胀和腹部不适症状。利那洛肽首次获得FDA批准上市是在2012年8月,随后于2019年1月15日进入中国市场,填补了IBS-C市场空白。由于其在安全性和有效性方面获得广泛认可,因此在IBS市场上有着广泛的前景。在国内市场方面,截至2022年,其整体销售额已超过1亿元。而在全球市场方面,2022年的销售额已经超过20亿美元。然而,利那洛肽核心化合物专利将于2024年1月24日到期。目前,国内有4家药企在布局该品种,分别是四川国为制药、双鹤药业(海南)、深圳翰宇药业、齐鲁制药(海南)。2023年6月27日,亿腾医药旗下的芦曲泊帕(稳可达®)新药(5.1类)成功获得国家药品监督管理局(NMPA)的上市批准。该药适用于成年患者,患有慢性肝病伴血小板减少症,且计划接受手术(包括诊断性操作)。2019年,亿腾医药与日本盐野义制药达成协议,获得了稳可达在中国大陆、港澳地区的产品开发和商业化权利。尽管这一药物的上市批准于6月份获得,但令人遗憾的是,其核心化合物专利将于2024年8月10日到期。根据CDE官网的数据,科伦药业已于8月17日提交了芦曲泊帕片的上市申请,这将是国内首个申报上市的芦曲泊帕片仿制药。这意味着芦曲泊帕片可能会在专利到期之前提前进入竞争市场。总之,这些药物凭借其独特的药理机制和治疗效果,在全球医药市场上占据了重要地位,并为患者带来了新的希望。然而,随着这些药物核心化合物专利的即将到期,国内外众多制药企业纷纷进入仿制药的研发与申报,预示着未来市场竞争将变得愈发激烈。这不仅将推动原研药企业不断创新,提高药物研发水平,也为广大患者带来了更多的用药选择与可能。在这波激流涌动的市场竞争中,我们期待看到更多具有创新性和高效性的药物诞生,满足患者日益增长的医疗需求。
标签:
【免责声明】
1.“高鹏说药材”致力于提供中药行业各类资讯信息,但不保证信息的合理性、准确性和完整性,且不对因信息的不合理、不准确或遗漏导致的任何损失或损害承担责任。
2.“高鹏说药材”部分文章信息来源于网络转载是出于传递更多信息之目的,并不意味着赞同其观点或证实其内容的真实性。如对内容有疑议,请及时与我平台联系。
3.“高鹏说药材”所有信息仅供参考,不做任何商业交易及或医疗服务的根据,如自行使用“高鹏说药材”内容发生偏差,我平台不承担任何责任,包括但不限于法律责任,赔偿责任。
4.“高鹏说药材”各类带“原创”标识的资讯,享有著作权及相关知识产权,未经本网站协议授权,任何媒体、网站、个人不得转载、链接或其他方式进行发布;经本网协议授权的转载或引用,必须注明“来源:高鹏说药材(www.gpsyc.com)”。违者本网站将依法追究法律责任。
5.本声明未涉及的问题参见国家有关法律法规,当本声明与国家法律法规冲突时,以国家法律法规为准。









 来源:广东药监局 近日,广东药监局发布了第五批重点项目、重点...
来源:广东药监局 近日,广东药监局发布了第五批重点项目、重点... 将“药食同源”作为中医药产业化的有效切入口,更大限度地发挥“...
将“药食同源”作为中医药产业化的有效切入口,更大限度地发挥“... 为贯彻落实《国务院办公厅关于推动药品集中带量采购工作常态化制...
为贯彻落实《国务院办公厅关于推动药品集中带量采购工作常态化制... 来源:安徽、湖北药监局近日,安徽、湖北药监局发布了两则行政处...
来源:安徽、湖北药监局近日,安徽、湖北药监局发布了两则行政处...




